Оглавление
Список сокращений
Введение
Глава I.
Обзор литературы
Глава II.
Материал и методы исследования
2.1 Общая характеристика больных
2.2 Лазерные установки
2.3 Методики исследования
2.3.1 Электрокардиографическое исследование
2.3.2 Холтеровское мониторирование
2.3.3 Эхокардиография
2.3.4 Велоэргометрия
2.3.5 Коронароангиография, вентрикулография
2.3.6 Стресс – эхокардиография
2.3.6.1 Сресс-ЭхоКГ с ВЭМ
2.3.6.2 Стресс-ЭхоКГ с добутамином
2.3.6.3 ЭхоКГ с нитроглицерино
2.3.7 Радионуклидные методы исследования
2.3.7.1 Планарная сцинтиграфия
миокарда с 201Tl
2.3.7.2 Однофотонная эмиссионная компьютерная томография
миокарда
2.3.7.3 ЭКГ-синхронизированная томосцинтиграфия миокарда
2.3.8
Биохимические исследования
2.3.9
Гистологические и морфологические исследования
2.3.10
Статистическая обработка
Глава
III. Клиническая характеристика больных. Показания к
операциям, типы выполненных вмешательств
3.1 Клиническая характеристика
больных
3.2 Отбор больных на операцию ТМЛР
3.3 Показания к сочетанным операциям
ТМЛР
3.4Методика оперативных вмешательств
3.5 Ведение больных в раннем
послеоперационном периоде
3.6 Обсуждение материала исследовани
Глава IV. Клинические результаты и обсуждение
4.1 Непосредственные результаты операций
4.1.1 Особенности интраоперационного и ближайшего
послеоперационного периода. Оценка интраоперационной травмы миокарда
4.1.2 Анализ летальности и осложнений
4.2 Обсуждение непосредственных результатов операций
4.3 Обследование больных через 3 месяца после операций
Заключение
Выводы
Практические рекомендации
Список литературы
СПИСОК СОКРАЩЕНИЙ.
АКШ – аортокоронарное
шунтирование
ВАБК – внутриаортальная
баллонная контрпульсация
ВТК – ветвь тупого края
ВЭМ – велоэргометрия
ДВ – диагональная ветвь
ИБС – ишемическая болезнь
сердца
КА – коронарная артерия
КФК – креатинфосфокиназа
ЛЖ – левый желудочек
ЛКА – левая коронарная артерия
ЛП – левое предсердие
МЖП – межжелудочковая
перегородка
МИРМ – минимальноинвазивная
реваскуляризация миокарда
МПМ – малое повреждение
миокарда
ОВ – огибающая ветвь
ОИМ – острый инфаркт миокарда
ПКА – правая коронарная
артерия
ПМЖВ – передняя
межжелудочковая ветвь
ПЭТ – позитронно-эмиссионная
томография
РФП – радиофармпрепарат
СЦМ – сцинтиграфия миокарда с
201-Tl
ТЛБАП – транслюминальная
балонная ангиопластика
ТМЛР – трансмиокардиальная
лазерная реваскуляризация миокарда
ФВ ЛЖ – фракция выброса левого
желудочка
ЧПЭС – чреспищеводная
стимуляция предсердий
ЧПЭХО КГ – чреспищеводная
эхокардиография
ЭКГ – электрокардиография
ЭХО КГ – эхокардиография
ВВЕДЕНИЕ
Актуальность проблемы.
Ишемическая болезнь сердца (ИБС) на
сегодняшний день остается одной из ведущих причин смертности во всем мире.
Кроме того, она сопровождается значительным числом осложнений с симптомами
стенокардии, аритмии сердечной недостаточности, связанной с ишемической
дисфункцией левого желудочка сердца. Несмотря на огромные успехи в традиционных
методах медикаментозного и хирургического лечения ИБС, таких как
аортокоронарное шунтирование и транслюминальная баллонная ангиопластика, все
еще остается целый ряд больных, которым эти методы применить не удается. Это,
прежде всего пациенты, у которых шунтирование коронарных артерий технически не
представляется возможным. Сюда входят диффузные атеросклеротические поражения
коронарных артерий, поражения дистального русла, либо коронарные артерии
небольших размеров, непригодные для наложения анастомозов и ангиопластики. Вот
почему огромное значение в настоящее время придается изучению альтернативных
методов реваскуляризации, и в частности, трансмиокардиальной лазерной
реваскуляризации миокарда (ТМЛР).
Начало экспериментальным
исследованиям положили работы J. Wearn [202] и C. Beck [34]. Они изучали
теоретическую возможность поступления крови в миокард прямо из полости левого
желудочка по специально созданным каналам. За основу принималась модель
перфузии миокарда у рептилий, у которых система коронарных артерий отсутствует,
а кровь доставляется из полости сердца в синусоиды.
В 60-е годы работами P. Sen [176],
R. Piffare [163] и др. [99] были продолжены экспериментальные исследования по
созданию искусственных трансмиокардиальных каналов методом акупунктуры.
Несмотря на обнадеживающие результаты, данная методика некоторое время
находилась в тени ввиду повышенного интереса в 60-70-е годы к хирургическому
лечению ишемической болезни сердца с помощью АКШ.
Новый этап в развитии данного
направления реваскуляризации миокарда начался в 1981 году работами M.
Mirhoseini и M. Cayton [135]. Они предложили высверливать каналы в миокарде с
помощью СО2 лазера. Цель этого метода заключалась в создании возможности
прямого попадания крови из левого желудочка в миокард. Основой для активного
изучения, развития и клинического применения этого метода являлся тот
выраженный клинический эффект, который он производил у больных со стенокардией.
По данным D. Cooley и соавт. [45] средний функциональный класс стенокардии
(CCS) после ТМЛР уменьшился с 3,76 до 2,40 через 3 месяца и далее до 1,50 через
6 месяцев. Причем отмечено, что состояние больных после операции улучшается
постепенно в течение 1 года.
Первоначально процедура ТМЛР
производилась преимущественно одновременно с АКШ и использованием
искусственного кровообращения. С созданием новых высокоэнергетичных 850 и 1000
Вт лазеров появилась возможность пробивать каналы в миокарде в течение одного
сердечного сокращения, то есть выполнить данную операцию на бьющемся сердце.
Это послужило новым толчком к дальнейшему развитию метода. Число подобных
операций в мире неуклонно растет. Если к 1995 году было сделано всего 300
операций ТМЛР в 25 медицинских центрах, то к концу 1998 года с использованием
новых высокоэнергетичных СО2 лазеров выполнено около 4 тысяч подобных
вмешательств.
Результат операции обычно
оценивается по улучшению самочувствия больных, повышению толерантности к
физической нагрузке, уменьшению клиники стенокардии и переводу больных в другой
функциональный класс. С целью объективизации результатов реваскуляризации
миокарда применяют нагрузочные пробы, сцинтиграфию миокарда с 201Tl, ПЭТ.
Как известно, первая
операция ТМЛР выполнялась в сочетании с АКШ. Как только была доказана
принципиальная возможность выполнения ТМЛР, и по мере того, как были
сконструированы соответствующие лазерные установки, позволяющие обезопасить
операции, ТМЛР стали применять в качестве изолированных процедур.
Однако, как показала история,
необходимость в интегрированных операциях не отпала. Более того, как оказалось,
в ряде случаев такая комбинация вмешательств не только желательна, но и
обязательна.
Как известно, наличие
поражений в дистальных сегментах коронарных артерий не влияет на
непосредственные результаты АКШ. Однако, в отдаленные сроки наличие дистальных
сужений и диффузного поражения русла коронарных артерий существенно увеличивает
число осложнений, количество случаев с возвратом стенокардии, заметно
укорачивает сроки эффективного функционирования шунтов и, нередко,
заканчивается фатально [94, 122, 168]. Как указывают H. Schaff и соавт.
[171] наличие нешунтабельных коронарных артерий является наиболее значительным
прогностическим признаком отдаленных осложнений и летальности после АКШ.
С другой стороны, с учетом
современных представлений о механизмах эффективности ТМЛР, все больше авторов
сходится во мнении, что несмотря на то, что у большинства больных с конечной
стадией поражения коронарных артерий развиваются коллатерали, для эффективности
ТМЛР очень важно, чтобы у больного был сохранен кровоток хотя бы по одной из
главных коронарных артерий [131].
В связи с этим вновь стала
актуальной проблема сочетанных операций. Тем не менее, до сих пор не выработаны
четкие показания к этой операции, нет единого подхода к послеоперационной
оценке эффективности данного метода. Многие моменты проведения самой операции
не указаны достаточно четко. Так, например, количество перфорационных отверстий
по данным разных авторов колеблется от 10 до 50, нет единого мнения в отношении
профилактики желудочковых аритмий, которые могут возникнуть во время операции.
Таким образом, операция ТМЛР
является достаточно новым и эффективным методом реваскуляризации миокарда,
который наряду с АКШ и ТЛБАП играет важную роль в лечении больных ИБС. Вместе с
тем как сама методика, так и трактовка результатов требуют дальнейшей
разработки.
Все это определило выбор цели
нашего исследования:
Цель исследования: изучить
непосредственные результаты операции ТМЛР в сочетании с методами прямой
реваскуляризации (МИРМ, АКШ) у больных ИБС.
Задачи исследования:
1. Провести
анализ осложнений и летальности в ближайшем послеоперационном периоде после
сочетанных операций ТМЛР и АКШ; разработать методы профилактики интра- и
послеоперационных осложнений.
2. Выработать
показания к сочетанным операциям ТМЛР+АКШ у больных ИБС.
3. Оценить
интраоперационное повреждение миокарда при воздействии лазером; определить
оптимальное количество перфораций при операциях с ТМЛР.
4. Оценить
эффективность сочетанных вмешательств (ТМЛР+АКШ) у больных ИБС с конечной
стадией поражения коронарных артерий.
Научная новизна и
практическая значимость.
В мировой литературе крайне мало
исследований, посвященных показаниям к операциям ТМЛР в сочетании с различными
методами прямой реваскуляризации миокарда, отбору больных на эти вмешательства.
Специальных исследований по профилактике интра- и послеоперационных осложнений
у этой группы больных не проводилось. Не изучено детально безопасное количество
перфораций лазером при выполнении различных видов ТМЛР. Также разрознены данные
по оценке повреждения миокарда после операций с применением ТМЛР. Изучение всех
этих вопросов позволит улучшить результаты хирургического лечения тяжелейшей
категории больных ИБС.
Положения,
выносимые на защиту.
1.
Трансмиокардиальная
лазерная реваскуляризация, дополняющая методы прямой реваскуляризации миокарда
(интегрированные вмешательства) – достаточно безопасная и эффективная
процедура. С накоплением опыта она сопровождается низким числом осложнений и
летальности.
2.
У больных ИБС
показаниями к сочетанным операциям ТМЛР с методами прямой реваскуляризации
миокарда являются: 1) выраженная клиника стенокардии, рефрактерная к обычной
антиангинальной терапии; 2) невозможность выполнения АКШ, либо ТЛБАП в связи с
диффузным поражением КА, поражением дистального русла или наличием мелких,
нешунтабельных КА; 3) наличие в области операции жизнеспособного миокарда; 4)
наличие хотя бы одной шунтабельной коронарной артерии.
3.
При изолированных
операциях ТМЛР следует выполнять не более 30 перфораций миокарда, а при
операциях ТМЛР в сочетании с методами прямой реваскуляризации миокарда не более
20.
4.
Оптимальным
методом оценки травмы миокарда после операций является определение активности
сердечного тропонина Т. Травма миокарда всегда более выражена после операций в
условиях искусственного кровообращения.
Работа выполнена в лаборатории
трансмиокардиальной лазерной реваскуляризации (зав. – д.м.н., профессор И.И.
Беришвили), отделении сочетанных поражений коронарных и периферических артерий
(зав. – д.м.н. И. Ю. Сигаев), клинико-диагностическом отделении (зав. – д.м.н.,
профессор Ю. И. Бузиашвили), отделе ядерной диагностики (зав. – д.м.н. И. П.
Асланиди), лаборатории биохимии (зав. – к.м.н. Мелкумян А.Л.).
Автор приносит искреннюю
благодарность И.В. Ключникову, М. Н. Вахромеевой, И.Л. Михайловой и всем
сотрудникам института, принимавшим непосредственное участие в работе. Без
дружеской поддержки и тесного контакта с сотрудниками целого ряда подразделений
Центра, проведение указанной работы было бы немыслимо.
ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ
трансмиокардиальная лазерная реваскуляризация ишемический
болезнь
Несмотря на значительные
успехи современной медицины, ишемическая болезнь сердца (ИБС) остается одной из
ведущих причин инвалидизации и смертности взрослого населения ведущих стран
мира [3, 82]. По данным Европейского кардиологического общества смертность от
ишемической болезни сердца в нашей стране оказалась наивысшей в Европе, как
среди лиц в возрасте от 35 до 65 лет, так и среди лиц старше 65 лет.
Хирургическая реваскуляризация при ИБС представляет собой одно из самых
значительных достижений медицины. Уже на заре применения метода было отмечено,
что в результате операции исчезают симптомы стенокардии, улучшается
переносимость физических нагрузок и снижается смертность.
Развитию хирургических
способов лечения ишемической болезни сердца придаётся очень большое значение
[3]. В настоящее время основными методами хирургического лечения
атеросклеротического поражения коронарных артерий являются различные варианты
аортокоронарного шунтирования (АКШ) и транслюминальной баллонной ангиопластики
(ТЛБАП), включая стентирование.
Исторически, попытки увеличить
кровоток в ишемизированном миокарде начинались с методов непрямой реваскуляризации
миокарда. Еще в 30-е годы C. Beck [34] с целью реваскуляризации миокарда
пересаживал сальник, париетальный перикард или медиастинальный жир к
поверхности сердца (C.Beck,
1935). Позднее, А. Vineberg с помощью интрамиокардиальной имплантации внутренней
грудной артерии пытался восстановить коллатеральный кровоток в миокарде [192,
193]. Эти операции не имели выраженного клинического эффекта, были
высокотравматичными и в дальнейшем уступили место в хирургическом лечении ИБС
методам прямой реваскуляризации миокарда. Шестидесятые годы ознаменовались
бурным развитием аортокоронарного шунтирования (АКШ) и повышенным интересом
многих исследователей к этому методу реваскуляризации миокарда.
Экспериментальное обоснование этого метода связано с работами В. П. Демихова
(1960), а первое клиническое использование — с пионерскими работами В. И.
Колесова [18], R. Favaloro [59] и D. Effler [58]. Анатомо-физиологическая
обоснованность и высокая клиническая эффективность метода послужили стимулом
для широкого распространения операции во многих клиниках и странах мира.
Однако, достигнув огромных успехов в лечении больных ИБС, хирурги вновь
столкнулись с неокончательной разрешимостью проблемы реваскуляризации миокарда.
Оказалось, что приблизительно в 25-30% случаев калибр коронарных сосудов
недостаточен для эффективного шунтирования [10, 58]. Более того, часть сосудов
подвержена диффузным изменениям, и они так же являются нешунтабельными. Не
менее сложна и проблема эффективной помощи больным, перенесшим две и более операции
АКШ и множественные ангиопластические процедуры [15, 170, 190].
Вновь возникшие вопросы заставили
исследователей по новому подойти к решению проблемы и попытаться доставить
кровь к ишемизированным участкам миокарда непосредственно из полости левого желудочка
(ЛЖ). Попытки реваскуляризации миокарда из полости ЛЖ предпринимались давно и
начинались они практически одновременно с началом разработок прямых методов
реваскуляризации миокарда. Исследователи пытались соединить интрамиокардиальную
сосудистую сеть с полостью левого желудочка, реваскуляризировать область ишемии
путем воздействия на эндокард с помощью насечек [121], либо его иссечения [85,
194]. Еще в 1957 году C. Massimo и L. Boffi [133] разработали экспериментальную
технику по созданию сообщений между полостью левого желудочка и миокардом,
используя Т-образные пластиковые трубки. Варианты этой техники со свободными
артериальными трансплантатами, полиэтиленовыми трубками были использованы и
другими исследователями [74, 121]. Позднее работами P. Sen, R. Piffare, A.
Kazei и других авторов были продолжены эксперименты по созданию искусственных
трансмиокардиальных каналов методом акупунктуры, исследовалась принципиальная
возможность поступления оксигенированной крови из полости левого желудочка в
ишемизированный миокард [99, 176, 196]. В 1967 году M. White и J. Hershey
впервые опубликовали данные по успешному клиническому применению
трансмиокардиальной механической акупунктуры у одного больного [83, 204]. P.
Walter и соавт. [198] создавали такие же каналы с помощью 1,4-4,0 мм канюль.
В нашей стране исследования в этом
направлении были начаты в 1978 году (Ю. М. Ишенин). Начиная с 1980 года,
группа, возглавляемая Ю. М. Ишениным, стала изучать неоангиогенез, и пришла к
выводу, что “высекание” туннеля в любом ишемизированном органе ведёт к
обязательному росту новых сосудистых связей, достаточных для компенсации
расстройств микроциркуляции [13]. Иными словами, ещё в 1990 году Ю. М. Ишениным
[14] было высказано предположение о том, что туннелирование стимулирует
эндогенный фактор роста сосудистой системы в миокарде. В своей недавней
публикации [14] о роли ангиопластических реакций в ишемизированных органах и
тканях, автор приводит характеристику основных направлений, по которым
необходимо стимулировать исследования для изучения проблемы ангиогенеза.
А. Я. Кононов предложил с целью
реваскуляризации миокарда имплантировать в него протез микрососудов с
последующей обработкой внутристеночного туннеля лазерным излучением [19].
Ближайшие результаты этих
механических методов «сверления» миокарда были обнадеживающими, однако,
клеточная инфильтрация в зоне повреждения, разрастание фиброзной ткани и
образование рубцов способствовали быстрому закрытию каналов и ограничивали
применение этих методов [115, 163]. Снижению интереса к подобным исследованиям,
в первую очередь, способствовали появившиеся сообщения об отличных клинических
результатах прямой реваскуляризации миокарда с помощью АКШ [59]. Но как это
часто бывает, интерес к проводимым ранее исследованиям остался, тем более что
на первых порах были получены определенные успехи. Как показал анализ неудач,
быстрое закрытие, фиброз и рубцевание создаваемых каналов было вызвано
преимущественно механической травмой. Поэтому возможность избежать грубого
механического воздействия давала определенные надежды и перспективы для
развития этого метода.
Второе рождение идея
реваскуляризации миокарда путём создания в нём множественных каналов обрела в
связи с созданием нового источника энергии — оптических квантовых генераторов
или лазеров (от англ. «Light Amplification by Stimulated Emission of Radiation»).
В 1969 году появилось сообщение Z.
Naprstek и R. Rockwell о возможности использования лазеров при лечении
заболеваний сердечно-сосудистой системы [151]. Использование лазера, как оказалось,
предотвращает необходимость удаления тканей за счет испарения внутриклеточной
жидкости. Как показали исследования Z. Naprstek и R. Rockwell [151],
воздействие нефокусированного лазера не влияет на сердечные сокращения, их
частоту, артериальное давление и электрическую активность сердца. Это позволяет
использовать его на бьющемся сердце. Причем он пенетрирует сердце от эпикарда
до эндокарда, практически не повреждая окружающие ткани. В том же 1969 году M.
Mirhoseini [135] начал эксперименты на собаках с использованием СО2 лазера,
созданного Th. Polyani [American Optical Company].
В 1971 году M. Mirhoseini выполнил
свою первую успешную серию, атравматично “просверлив” миокард собаки на
бьющемся сердце. В этом эксперименте на 24 собаках он использовал 400 Вт СО2
лазер, сконструированный американской оптической корпорацией в Сойсбридже (шт.
Массачусетс, США) для индустриальных целей. Лазер имел длительность импульса в
100 мс и мощность 400 Вт, что эквивалентно 400 Дж/импульс. Это была первая
попытка обеспечения ЭКГ синхронизации лазера (с пиком зубца R).
Возобновлению экспериментальных
исследований по трансмиокардиальной реваскуляризации миокарда способствовало
появление в середине 70-х годов материалов больших исследований по оценке
результатов аортокоронарного шунтирования [L. Kouchoukos, 1976, G. McIntosh,
1978]. Было показано, что существует большая группа больных, которым невозможно
выполнить АКШ по ряду причин. Таким образом, развитие новых технологий и, в
частности, появление лазеров, пригодных для применения в медицине, с одной
стороны, потребность в поиске новых методов реваскуляризации миокарда для
больных с нешунтабельными артериями, с другой стороны, а так же все
предшествующее изучение перфузии миокарда, теоретическая возможность прямой
реваскуляризации миокарда из полости левого желудочка – все эти факторы явились
предпосылками для первоначально экспериментального исследования [135, 136], а в
последующем и клинического применения трансмиокардиальной лазерной
реваскуляризации [137].
Теоретической базой ТМЛР послужили
работы J. Wearn и соавт. (1933), которые на основании 15 аутопсий у человека
описали уникальное явление микроанатомии сердца – наличие в нем
интрамиокардиальных синусоид [90, 202]. Синусоиды, различаясь по размерам и
структуре, представляют собой сеть артерио-полостных, артерио-артериолярных,
артерио-венозных и венозно-полостных соединений [143, 178, 188]. Подобная
система кровоснабжения миокарда присутствует в основном у рептилий, и, в
частности, у аллигаторов, у которых 70% миокарда перфузируется из полости
левого желудочка и только 30% — посредством коронарных артерий [108]. У
человека в нормальных условиях синусоидный тип кровообращения сердца
присутствует лишь в зародыше, постепенно заменяясь на эпикардиально —
коронарный в ходе дальнейшего развития. При ряде пороков, и, в частности,
таких, как гипоплазия левого желудочка [152], либо гипоплазия правого желудочка
(при атрезии легочной артерии с интактной межжелудочковой перегородкой) так же
находят функционирование синусоид [67, 72, 153]. Кроме того, кровоток через
миокардиальные синусоиды заметно увеличивается при стрессовых ситуациях и при
полной окклюзии коронарных артерий [45]. Сегодня в литературе описаны и
казуистические случаи сохранения синусоид у взрослых людей [182]. Данные факты
позволили предположить, что с помощью лазера можно создать каналы, соединяющие
полость левого желудочка с интрамиокардиальной сетью синусоид, позволяющие
осуществить как бы “рептилизацию” или «эмбрионизацию» человеческого
сердца.
В конце 1983 года Mirhoseini [137]
была выполнена операция трансмиокардиальной лазерной реваскуляризации (ТМЛР) в
сочетании с АКШ. Операция была выполнена в Милуоки (шт. Висконсин, США) в
медицинском центре Св. Луки. В последующем Mirhoseini выполнил серию из 12-ти
операций, сочетающих АКШ и ТМЛР.
В 1989 году, через 4 года после
операции умер один из больных первой серии (первой фазы исследований в США).
Больной умер от несердечных причин, и родственники предоставили сердце в
госпиталь Св. Луки. На вскрытии было выявлено, что все каналы проходимы на всю
длину, за исключением последних эпикардиальных двух миллиметров [61].
Говоря о начале операций на бьющемся
сердце, очевидно, следует отметить еще одну важную дату. В 1987 году, на
Рождество, администрация Сетона (медицинский центр в Дэли Сити, шт. Калифорния,
США) приняла решение начать разработку программы по ТМЛР.
В январе 1990 года J. Crew [47] из
Сетонского медицинского центра (Daly City, California) выполнил первую операцию
изолированной ТМЛР на бьющемся сердце в США. Эта операция была выполнена с
помощью Heart Laser первой генерации. Операция выполнена 82-летнему мужчине,
который ранее перенес 2 операции АКШ. С тех пор до 1998 года в Сетонском
медицинском центре было выполнено 25 операций ТМЛР на бьющемся сердце.
Как показали первые экспериментальные
исследования [24, 25, 139, 140], каналы, создаваемые с помощью лазера, остаются
открытыми и могут перфузировать миокард, защищая его от ишемии. Первые
гистологические данные о проходимости трансмиокардиальных каналов после воздействия
лазера представил М. Mirhoseini. Он и его коллеги сообщили об оставшихся
открытыми в течение 2-х лет после операции каналах [139, 140]. Так по его
данным, каналы изнутри были покрыты эндотелием и оставались проходимыми. Вокруг
каналов сохранялся жизнеспособный миокард. Позднее M. Okada и соавт. так же
сообщили о проходимых каналах через несколько лет после операции [156, 157,
158]. Причем считается, что M. Okada первым использовал лазерное воздействие на
миокард за пределами США. На самом деле, вслед за M. Mirhoseini, первые
успешные операции по трансмиокардиальной лазерной реваскуляризации миокарда
были проведены отечественными хирургами Ю. Ю. Бредикисом и О. Н. Скобелкиным в
1984 году с помощью эрбиевого лазера [6, 7, 8, 12, 20, 24, 25]. Многочисленные
эксперименты на животных показали наличие проходимых каналов в разные
промежутки времени [80, 86, 87, 93, 209]. К. Horvath продемонстрировал не
только 30-дневную проходимость каналов после ТМЛР, но и улучшение
контрактильности миокарда в экспериментальной модели острой ишемии на овцах
[87]. В поддержку этих экспериментальных исследований были даны короткие
сообщения об единичных наблюдениях проходимости каналов на вскрытиях в
различные сроки после операции [44].
Таким образом, многие исследователи
сходились во мнении, что каналы остаются открытыми и проходимыми длительное
время. Причина этого, на их взгляд, кроется в отсрочке нормального
репаративного процесса в миокарде, сопутствующего вапоризации и карбонизации
клеток лазером, который ингибирует миграцию лимфоцитов, макрофагов и
фибробластов к зоне лазерного воздействия. Некоторыми авторами приводились
сравнения трансмиокардиальных лазерных каналов и каналов, проделанных обычной
иглой, в которых отмечалось постоянное присутствие эндотелизированных микрососудистых
сплетений в области воздействия лазерного луча [127]. Так R. Hardy отмечал, что
каналы после обычной акупунктуры закрывались в течение 2-х суток, в то время
как каналы, проделанные лазером оставались открытыми как минимум 2 недели [80].
В то же время имеются противоречивые данные относительно того, что лазерное
воздействие имеет какие-либо преимущества по сравнению с обычной акупунктурой
[42, 207].
Внедрение ТМЛР в широкую клиническую
практику привело к появлению большого числа работ, в которых авторы стали
детально изучать структуру каналов, созданных лазером [77, 78, 80, 199]. И в
противоположность первым сообщениям о проходимости каналов вышло много
публикаций о том, что каналы все же закрываются в различные сроки после
операции. Большой материал представили T. Krabatsch и соавт. (1996, 1997). На
основании патоморфологического исследования сердец 11 больных, умерших в
различные сроки после ТМЛР (на 1 — 20-е сутки), было показано, что к 5 суткам
после операции все каналы были закрыты фибриновыми сгустками, эритроцитами и
макрофагами. Вокруг каналов отмечалась зона некроза толщиной 500 мкм [111]. Ко
2-3 неделе после операции отмечено замещение свежих тромбов грануляционной
тканью различной плотности [112]. Сходную гистологическую картину у умерших больных
после операции ТМЛР приводят и другие авторы [37, 49, 71]. В экспериментальных
моделях на различных животных с использованием как СО2, так и гольмиевого
лазеров, в последнее время не было обнаружено открытых и проходимых каналов
[36, 61, 63, 73, 107, 145, 146, 160].
Таким образом, на сегодняшний день с
большой долей уверенности можно сказать, что каналы, проделанные в миокарде с
помощью лазеров различных типов, закрываются в течение ближайших 24 — 48 часов
после операции. Вначале в просвете канала формируются тромбы, состоящие из
коллагеновых волокон и клеточных элементов, впоследствии происходит
репаративный фиброз и замещение тромбов грануляционной тканью, характерной для
обычного воспалительного процесса [70, 71, 113].
Разноречивые суждения о
проходимости каналов не позволяют прийти к единому мнению о механизме
положительного клинического эффекта ТМЛР. Первые представления о создании и
функционировании соустий между полостью левого желудочка и интрамиокардиальными
синусоидами сегодня опровергаются многочисленными экспериментальными и
клиническими данными о том, что созданные лазером каналы в ближайшее после
операции время закрываются [124, 125, 132, 175]. Несмотря на то, что некоторые
авторы находят функционирующие трансмиокардиальные каналы по данным контрастной
вентрикулографии, контрастной эхокардиографии, либо в экспериментальных
моделях, убедительных данных, свидетельствующих о длительной проходимости
каналов, нет. Наиболее вероятной, на сегодняшний день, является гипотеза о
стимуляции в зоне воздействия лазерного луча неоангиогенеза и, вследствие
этого, улучшении перфузии ишемизированных зон миокарда [38, 42, 108, 126, 127,
141, 146, 161, 181, 208]. И действительно, как было сказано выше, в зонах,
прилегающих к созданным лазером каналам, многие авторы находят множественные
эндотелизированные образования, представляющие собой микрососудистую сеть.
Развитию микрососудистой сети могут способствовать фибриновые тромбы в просвете
созданных каналов и термически поврежденный миокард, посредством фактора роста
фибробластов, трансформирующего рост фактора-бета, а так же сосудистого
эндотелиального фактора роста [36, 62]. Кроме того, некоторыми авторами в зоне
воздействия лазерного луча были обнаружены коллаген IV типа, характерный для
базальной мембраны формирующихся сосудов [113] и a и b 3-интегрин, необходимые для адгезии эндотелиальных клеток к
экстрацеллюлярным матричным компонентам, что наблюдается при неоангиогенезе
[36, 123]. Allan M. Lansing сообщил об обнаружении у 23 пациентов, которым была
выполнена ТМЛР, сосудистого эндотелиального фактора роста (VEGF), причем концентрация его в крови на
7 день после операции увеличилась на 400% по сравнению с дооперационной [121].
Еще одним фактом, свидетельствующим в пользу теории ангиогенеза после ТМЛР,
является постепенное улучшение клиники в течение первого года у больных,
перенесших ТМЛР [89].
Другими теориями,
объясняющими клинический эффект ТМЛР, могут быть: локальная “анестезия”
вследствие деструкции миокардиальных нервных окончаний и эфферентных нервных
путей [84, 98, 116, 181] с последующей миокардиальной “реабилитацией” и
вторичным формированием коллатерального кровотока; стимуляция вазодилатации и
образование коллатерального кровотока вследствие термоакустического эффекта или
высвобождения тканевых вазоактивных веществ; не исключен так же эффект плацебо.
Попытки ряда
исследователей расширить показания к ТМЛР и применить его при острой ишемии
миокарда успеха не имели. Только в двух экспериментах [86, 95] был отмечен
протективный эффект лазерной реваскуляризации в опытах с перевязкой передней
межжелудочковой ветвью (ПМЖВ). В остальных же экспериментальных работах многие
авторы указывают на то, что при острой ишемии эффект ТМЛР минимален и не может
быть достаточным для адекватной защиты миокарда [56, 81, 107, 117, 164, 165,
200, 201, 206, 207].
Учитывая появление новых мощных
лазеров и, соответственно, новых подходов к использованию ТМЛР в качестве
самостоятельного метода, в США был разработан двухэтапный протокол клинических
исследований. Первый этап предполагал оценить эффективность метода как
дополнительной процедуры у больных, которым выполнялось АКШ. В США к выполнению
первого этапа протокола был привлечен госпиталь св. Луки в Милуоки. На этом
этапе 12 больных были подвергнуты комбинированной реваскуляризации миокарда —
АКШ и лазерной реканализации. Критериями отбора больных на операцию служили:
диффузное многососудистое поражение, полная окклюзия хотя бы одного сосуда,
обратимость изменений миокарда в зоне, подвергающейся лазерной
реваскуляризации, и наличие хотя бы одного сосуда, подлежащему шунтированию.
Операции выполняли на остановленном сердце, после того, как по обычной методике
выполнялось шунтирование коронарной артерии, приступали к созданию каналов с
помощью лазера. 80 Вт СО2 лазером перфорировали трансмиокардиальные каналы в
направлении от эпикарда к эндокарду, используя свободно перемещающийся рукав с
фокусным расстоянием 125 мм и диаметром создаваемых в миокарде отверстий 0,17
мм. Число отверстий в миокарде определялось размером зоны, требующей
реваскуляризации. Обычно число отверстий составляло 10-12.
Комментируя первые результаты
[140], авторы пришли к выводу, что трансмиокардиальная реваскуляризация
миокарда с помощью СО2 лазера является жизнеспособным альтернативным методом
лечения ишемизированного миокарда. Послеоперационные исследования показали
увеличение зон потребления таллия по данным сцинтиграфии в областях лазерной
реваскуляризации, на вентрикулограммах у 6 из 10 больных обнаружены проходимые
каналы. Сократимость миокарда ЛЖ улучшилась у 8 из 10 больных [140]. Таким
образом, больные с диффузным поражением коронарных артерий, малым калибром
пораженных сосудов и с плохим результатом множественного шунтирования являлись
подходящими кандидатами для этой процедуры [43, 159].
Второй этап клинических испытаний
лазерной реваскуляризации предполагал использование ТМЛР в качестве
самостоятельной процедуры. Он был начат после того, как был сконструирован
Heart Lazer (1992) синхронизированный с электрокардиограммой (ЭКГ). К этой
работе были привлечены 4 центра в США (госпитали и университетские клиники
Хьюстона, Бостона, Сан-Франциско и Милуоки), а для проделывания каналов в
миокарде стали применять высокоэнергетические 850 Вт СО2 лазеры. Показанием к
операции изолированной ТМЛР являлась стенокардия, не поддающаяся
медикаментозному лечению у больных, у которых анатомические особенности не
позволяли провести обычные методы реваскуляризации миокарда, такие как АКШ или
ТЛБАП. Противопоказаниями к ТМЛР считали ФВ ЛЖ < 30%, серьезные системные
заболевания, невозможность перенести торакотомию [179]. Испытания по второму
протоколу были прекращены, после того как были выполнены операции 200 больным.
Все операции выполнялись высокоэнергетическими СО2 лазерами из левой
переднебоковой торакотомии под общей анестезией с использованием двухпросветных
интубационных трубок [75, 184]. На 1 см2 миокарда делали 1 канал,
приблизительно 25-30 каналов за одну операцию. Кровотечение обычно
останавливалось самостоятельно в течение 1-2 минут, либо требовало прижатия
марлевым тупфером или прошивания. Операционная рана зашивалась с оставлением
дренажей в плевральной полости, и больные, как правило, были экстубированы еще
в операционной. Длительность операции составляла 1,5-2 часа.
Новое поколение лазеров способно было
создавать 1 мм трансмуральные каналы в миокарде в течение одного сердечного
цикла, что позволяло выполнять операцию на работающем сердце. Одним из наиболее
важных технологических достижений комплекса сердечного лазера была связь
механизма лазера со встроенным монитором ЭКГ, который, в свою очередь,
контролировал через датчики ЭКГ пациента. На основании экспериментальных работ
было установлено, что импульсная энергия лазера должна выдаваться на сердце на
пике зубца R и до возникновения зубца Т, что позволяло исключить любое
воздействие на проводящую систему, которое могло бы привести к аритмии или
фибрилляции желудочков. Важным моментом проведения операции являлся контроль
пенетрации луча лазера в полость ЛЖ. Первоначально адекватность пенетрации
оценивали по появлению фонтанчика крови из полости ЛЖ, но позднее, с развитием
метода чреспищеводной эхокардиографии (ЧП ЭхоКГ), последнюю стали применять с
целью подтверждения проникновения лазерного луча в полость ЛЖ. На экране
монитора при пенетрации миокарда в полости ЛЖ появлялись хорошо видимые
пузырьки, представляющие собой турбулентный поток крови и пары воды, выпаренные
из миокарда под действием лазера [47, 48, 179]. Сегодня разработаны и другие
формы контроля перфорации миокарда, в частности, допплерография сонных артерий
[93].
Согласно второму этапу протокола,
после операции у больных оценивали частоту и интенсивность стенокардии, эпизоды
нестабильной стенокардии, инфаркты миокарда и другие клинические показатели,
такие, как нагрузочные тесты, сцинтиграфия миокарда с таллием [64, 65, 45]. Из
числа больных, которым через 3 месяца (n=159), 6 месяцев (n=143) и 12 месяцев
(n=95) после операции проведено полное обследование, выявившее клиническую
эффективность метода, класс стенокардии (CCS) с III и IV снизился до 0, I или
II у 78%, 77% и 79% больных соответственно, а у 30%, 34% и 30% больных,
соответственно, полностью исчезли симптомы стенокардии [88, 89]. Кроме этого,
число повторных госпитализаций после операции снизилось с 2,5 до 0,5 на одного
пациента в год [89]. В этом исследовании периоперационная летальность у первых
97 больных составила 11%, снизившись до 4% у оставшихся 104 больных за счет
более строгого отбора на операцию с учетом возраста, сниженной сократительной
способности миокарда и других факторов риска. После операции, по данным
сцинтиграфии с таллием, отмечено уменьшение числа дефектов наполнения в зонах
миокарда, леченных с помощью лазера [179, 89], улучшается регионарная
сократимость миокарда по данным ЭхоКГ с добутамином [54]. Однако более заметным
было увеличение субэндокардиальной перфузии по отношению к субэпикардиальной по
данным позитронно-эмиссионной томографии (ПЭТ) [45]. Так, по данным O. Frazier
(1995), отношение субэндокардиальной перфузии к субэпикардиальной возросло на
14% через 3 месяца после операции и на 21% — через 6 месяцев (p<0,001) [64,
65]. Кроме этого, авторы отмечают незначительное увеличение ФВ ЛЖ с 48±10% до 50±8% через 12 месяцев после операции
[45]. Увеличение ФВ ЛЖ особенно заметно при проведении стрессовых проб, когда
ФВ увеличивается на 19% по сравнению с дооперационной, улучшается так же
кинетика стенок ЛЖ, подвергшихся лазерной реваскуляризации [64].
Таким образом, мультицентровые
клинические испытания ТМЛР, как самостоятельного метода лечения больных ИБС,
позволили окончательно считать его альтернативным методом реваскуляризации
миокарда, достаточно эффективным и безопасным в применении [32, 35, 60, 101,
148, 159, 172, 173]. Преимущества этого метода очевидны. Это, прежде всего,
выполнение операции на работающем сердце и предотвращение повреждающего
действия искусственного кровообращения, укорочение времени операции до 1-2
часов, отсутствие необходимости гемотрансфузии, уменьшение времени пребывания в
стационаре и восстановительного периода, значительное снижение необходимости
приема медикаментов, меньшая себестоимость процедуры, улучшение качества жизни
пациентов после операции и гораздо более низкая повторная обращаемость больных
с рефрактерной стенокардией.
Horvath и соавт. опубликовали
результаты мультицентрового исследования, в котором 200 пациентов с тяжелой,
рефрактерной к лечению ИБС были подвергнуты ТМЛР [89]. Периоперационная
смертность составила 9%. Через 3, 6 и 12 месяцев после операции класс
стенокардии был достоверно ниже исходного. Частота госпитализаций по поводу
ИБС, составлявшая до лечения в среднем 2.5 раз в год, уменьшилась до 0.4. По
результатам радионуклидной перфузионной сцинтиграфии или позитронно-эмиссионной
томографии, после ТМЛР уменьшился и общий объем ишемизированного миокарда в
передней стенке ЛЖ, которая подвергалась лазерной реваскуляризации.
Для того, чтобы оценить эффективность
ТМЛР у больных с выраженной стенокардией и сравнить ее с результатами лечения
той же группы больных медикаментозными средствами, был предпринят третий этап
исследования, в который вошли 12 ведущих центров США, занимающихся ТМЛР. На
ежегодной 77-й сессии Американской ассоциации торакальных хирургов R. March и
соавт. [130] представили результаты этих исследований. Из 77 пациентов,
первоначально подвергшихся ТМЛР с использованием СО2 лазера, у 72% наступило
улучшение как минимум на 2 ФК. Из 83 пациентов, которые лечились
медикаментозно, ФК не изменился у 69%, а у 31% больных даже ухудшился. Через 6
месяцев после ТМЛР выживаемость, отсутствие симптомов нестабильной стенокардии
или отсутствие перехода больных в IV ФК наблюдались у 73% больных, в то время
как среди пациентов, пролеченных медикаментозно этот показатель составил всего
12%. Качество жизни улучшилось на 127% после ТМЛР и не изменилось в группе с
медикаментозной терапией. Двадцать шесть пациентов (31%) из группы
медикаментозной терапии пришлось оперировать из-за ухудшения состояния,
летальность в этой группе составила 25%, в сравнении с 1% летальностью при
изначально выполненной операции. На основании этого авторы сделали вывод, что у
больных с выраженной стенокардией выживаемость, качество жизни и функциональный
класс (ФК) стенокардии при использовании ТМЛР значительно улучшаются.
Продолжение медикаментозной терапии на фоне ухудшающегося статуса повышает риск
ТМЛР и ухудшает прогноз, что ставит вопрос о своевременном выполнении этой
операции [31, 130].
В 1995 году было начато
контролируемое рандомизированное исследование по сопоставлению результатов ТМЛР
с данными медикаментозного лечения у больных с III и IV ФК стенокардии. В
исследовании также была подтверждена эффективность ТМЛР в устранении
стенокардии и улучшении перфузии миокарда [131].
Практически параллельно с
СО2 лазером, для ТМЛР стали разрабатываться и гольмиевые лазеры. Так, компания
— предшественница сегодняшней корпорации Eclipse, начала свои разработки в этом
направлении в 1989 г., то есть практически вслед за корпорацией PLC.
К 1994 г. сразу 2 вновь
созданные компании (уже упоминавшаяся Eclipse и CardioGenesis ) сконструировали
Ho:YAG лазеры для ТМЛР. Они, и еще одна компания — Trymedine — задались целью
разработать Ho:YAG лазеры для выполнения ТМЛР “изнутри- наружу” (inside — out).
Основоположники и вдохновители идеи
ТМЛР — M. Mirhoseini, J. Fisher и другие, — очевидно, искренне верившие в
длительную проходимость лазерных каналов (и полагая, что для этого необходимо
формирование “идеально” ровных и гладкостенных каналов с небольшим термическим
повреждением миокарда), отнеслись к идее “сверления” c помощью гольмиевых
лазеров (формирующих зигзагообразные каналы с выраженным повреждением миокарда)
весьма скептически, полагая, что разработчиками гольмиевых лазеров движет
больше желание, нежели объективные основания и здравый смысл.
Тем не менее, такие
операции стали выполняться. Но сначала гольмиевые лазеры стали использоваться
по традиционной методике с перфорированием миокарда от эпикарда к эндокарду.
Первая такая операция с помощью гольмиевого лазера корпорации CardioGenesis
была выполнена в марте 1996 г., и уже в октябре 1996 г. на 10-й ежегодной
конференции Европейской ассоциации кардио-торакальных хирургов в Праге был
созван специальный сателлитный симпозиум, на котором A. Diegeler [51]
представил предварительные данные мультицентрового исследования по анализу
результатов клинического использования гольмиевого лазера в трех центрах США
(Stanford, Columbia, Washington) и пяти центрах Европы [Лейпциг и Бад
Оеунхаузен (Германия), Вена (Австрия), Уллеваа (Норвегия), Лунд (Швеция)].
В исследованиях была
проанализирована динамика функционального класса стенокардии, переносимости
нагрузок, данные стресс-сцинтиграфии с Tl — 201 и дипиридамолом и качество жизни
до и после операции ТМЛР. Как показали эти исследования, у 93% больных класс
стенокардии снизился как минимум на 1 единицу, а у 62% — на 2 единицы и более.
Аналогично, достоверно (р<0,01) улучшилась переносимость нагрузок.
Недавно D. Burkhoff и
соавт. [38] опубликовали результаты рандомизированного исследования по
сопоставлению результатов ТМЛР с помощью Ho:YAG лазера компании CardioGenesis у
92 больных и медикаментозного лечения у 90 больных, проведенного в 16 центрах
США.
Авторы оценивали:
— класс стенокардии;
— переносимость нагрузок;
— качество жизни;
— дипиридамоловый
таллиевый стресс-тест.
Заключение, которое было
сделано по материалам данного рандомизированного исследования, гласит:
ТМЛР:
—
снижает класс
стенокардии;
—
увеличивает
толерантность к физическим нагрузкам;
—
улучшает качество
жизни.
В марте же 1996 года, т.
е. параллельно, были начаты операции ТМЛР, выполняемые с помощью гольмиевого
лазера корпорации Eclipse [31]. А уже в сентябре 1998 г. на очередной
конференции Европейской ассоциации кардио-торакальных хирургов в Брюсселе были
представлены данные мультицентрового рандомизированного исследования,
выполненного у 221 больного из 21 центра, в котором были сопоставлены
результаты ТМЛР в сочетании с АКШ и изолированного АКШ. Как оказалось,
летальность во второй группе в 8 (!) раз превышала таковую в первой (7% и 0,9%,
соответственно).
В 1999 г. K. Allen и
соавт. [31] опубликовали результаты сопоставлений ТМЛР, выполненной с помощью
Ho:YAG лазера фирмы Eclipse, и медикаментозного лечения по данным оценки
состояния 275 больных, пролеченных с помощью указанных методик в 18 центрах
США.
Результаты этого рандомизированного
мультицентрового исследования свидетельствуют о снижении класса стенокардии и
уменьшении числа сердечных осложнений по сравнению с больными, леченными
медикаментозно.
Использование низкоэнергетических
гольмиевых (Ho:YAG) лазеров, которые излучают импульсы в пульсирующем режиме с
длиной волны 2,1 мкм, стало новым этапом в развитии ТМЛР. Излучение с такой
длиной волны способно передаваться посредством фиброволоконной оптики, что дает
определенные преимущества в клиническом применении гольмиевых лазеров.
Экспериментальные исследования [17, 22, 107, 145, 169, 197, 210] показали, что
применение гольмиевых лазеров безопасно, не вызывает серьезных дизритмий, а
гистологическое сравнение каналов, созданных гольмиевым и СО2 лазерами, не
выявило принципиальных различий [62]. А использование фиброволоконной оптики
создает целый ряд преимуществ. Во-первых, гибкое волокно дает возможность
достигать любой зоны миокарда. Во-вторых, появилась возможность выполнить ТМЛР
из самой полости ЛЖ, так называемую эндокардиальную ТМЛР [97, 105, 106, 209].
Поиски возможностей использования
ТМЛР для формирования каналов с внутренней эндокардиальной стороны миокарда
были начаты еще в 1991 году. Несомненно, эту группу исследователей воодушевило
использование лазерных технологий в ангиопластике, и, в частности,
использование для этих целей XeCl лазера с длиной волны 301 нм.
В экспериментах in vivo удалось
показать, что создание таких каналов принципиально возможно, и более того,
анализ перфузии миокарда с помощью микросфер выявил кровоток через созданные
лазером каналы [107]. Кроме того, появились экспериментальные работы об
использовании эндокардиальной ТМЛР посредством чрескожного бедренного доступа
как при ТЛБАП [100, 154, 177], что в совокупности с другими преимуществами
делает этот метод доступным для крайне тяжелых больных. Группа итальянских
хирургов, под руководством M. Galli, сообщила о выполнении 39 операций
чрезкожной ТМЛР с использованием гольмиевого лазера [69]. Результаты этих
вмешательств свидетельствуют о большой перспективе малоинвазивной ТМЛР.
Недавно о результатах ТМЛР с
использованием еще одного вида лазеров, а именно эксимерного, на большой серии
операций, доложил доктор M. Klein из университета Генриха Гейне (Дюссельдорф,
Германия). Но на 126 операций ТМЛР была использована как самостоятельный метод
только у 4 больных [103]. Эти факты свидетельствуют о том, что диапазон
использования низкоэнергетических лазеров в качестве самостоятельного метода лечения
ограничен.
И, тем не менее, независимо от того,
используются низкоэнергетические лазеры самостоятельно или в сочетании с АКШ,
результаты их использования вполне удовлетворительны и сопоставимы с
применением СО2 лазеров.
Другое достижение современных технологий
– видеоторакоскопическая техника – так же нашло применение в области ТМЛР. В
ряде экспериментальных работ авторы доказали возможность использования
торакоскопического оборудования для создания каналов с помощью СО2 лазеров [76,
50], показав при этом, что процедура становится безопаснее и эффективнее при
миниинвазивной технологии, а так же позволяет снизить число осложнений и
себестоимость лечения. A. Milano и соавт. [134] уже сообщил о двух больных,
прооперированных торакоскопически. Таким образом,
торакоскопическая ТМЛР является логическим продолжением этого вида лечения
больных ИБС.
Как известно, первая
операция ТМЛР выполнялась в сочетании с АКШ. Как только была доказана
принципиальная возможность выполнения ТМЛР, и по мере того, как были сконструированы
соответствующие лазерные установки, позволяющие обезопасить операции, ТМЛР
стали применять в качестве изолированных процедур.
Однако, как показала
история, необходимость в интегрированных операциях не отпала. Более того, как
оказалось, в ряде случаев такая комбинация вмешательств не только желательна,
но и обязательна.
Как известно, наличие
поражений в дистальных сегментах коронарных артерий не влияет на
непосредственные результаты АКШ. Однако, в отдаленные сроки наличие дистальных
сужений и диффузного поражения русла коронарных артерий существенно увеличивает
число осложнений, количество случаев с возвратом стенокардии, заметно
укорачивает сроки эффективного функционирования шунтов и, нередко,
заканчивается фатально [94, 122, 168]. Как указывают H. Schaff и соавт.
[171] наличие нешунтабельных коронарных артерий является наиболее значительным
прогностическим признаком отдаленных осложнений и летальности после АКШ.
С другой стороны, с
учетом современных представлений о механизмах эффективности ТМЛР, все больше
авторов сходится во мнении, что несмотря на то, что у большинства больных с
конечной стадией поражения коронарных артерий развиваются коллатерали, для
эффективности ТМЛР очень важно, чтобы у больного был сохранен кровоток хотя бы
по одной из главных коронарных артерий [131].
Наметившая в последнее
время очевидная тенденция выполнения интегрированных операций, предполагающих
сочетание ТМЛР и АКШ, преследует 2 цели. Во-первых, эффективное
функционирование микрососудистой сети и коллатералей, индуцированных ТМЛР,
возможно только при наличии магистрального кровотока хотя бы по одной из
главных коронарных артерий, чего можно достичь только с помощью АКШ. Во-вторых,
при наличии хотя бы одного шунтабельного сосуда, очевидно, при отсутствии
каких-либо противопоказаний, его целесообразно шунтировать. J. Vincent и соавт. [191] сочетали ТМЛР с АКШ в 48% случаев, A.
Diegeler и соавт. [52] — у 42,8% пациентов. Согласно S. Burns и соавт. [39],
представивших суммарный опыт проведения ТМЛР в 21 центре Европы и Азии у 967
пациентов, частота сочетания ТМЛР с АКШ в целом на все центры составила 32%. В
этом смысле, очевидно, уместно высказывание A. Lansing [119]: “Мы
должны лечить не какую-нибудь зону миокарда, мы должны лечить всё сердце”. T. Krabatsch и соавт. [110] также отдает
предпочтение шунтированию всех шунтабельных коронарных артерий, сочетая АКШ с
ТМЛР в зонах нешунтабельных коронарных артерий. Они выполнили 17 таких операций
с нулевой летальностью.
Как показали результаты
изучения факторов риска летальности по данным 132 изолированных операций ТМЛР,
выполненных с помощью СО2 лазера, у больных с хорошим коронарным кровотоком
хотя бы в зоне одной коронарной артерии или бассейне коронарной артерии с хотя
бы одним проходимым шунтом после ранее выполненной АКШ, имеется значительно
меньший риск интраоперационной и отдаленной летальности [38].
Сегодня операции АКШ
выполняются как в сочетании с СО2 [57, 191], так и с гольмиевым [29, 30, 52], и
эксимерным [103, 104] лазерами.
Результаты свидетельствуют о хорошей
переносимости операции (периоперационная выживаемость 89,2%) и значительном
улучшения самочувствия после нее. Все без исключения пациенты отзывались о
своем самочувствии после операции, как “лучше, чем год назад”. У 40% больных
после ТМЛР ФК стенокардии (CCS) снизился с III-IV до 0-I, а в группе после
ТМЛР+АКШ такое снижение наблюдалось у 84% пациентов.
Большой опыт накоплен в
университетском центре Марбурга (Германия) под руководством B. Maisch. За
период с 1994 года там выполнено 134 операции, из них 67 ТМЛР и 67 ТМЛР в
сочетании с АКШ [36, 68, 114, 128, 143, 144]. После операции отмечено
значительное улучшение клинической картины, снижение ФК до 1,7 (CCS) в группе
ТМЛР + АКШ и до 1,9 (CCS) в группе ТМЛР. Толерантность к физической нагрузке
повысилась с 21 до 89 Вт по данным велоэргометрии, сцинтиграфия выявила
улучшение перфузии миокарда вплоть до 40% [114]. В представленной литературе
авторы не сообщают о летальных исходах в периоперационном периоде.
Тенденции современной кардиохирургии
в использовании минимально инвазивных процедур находят свое отражение и
применительно к ТМЛР. Это относится не только к минимальному доступу или
упомянутым выше торакоскопическим операциям. Возможность выполнения ТМЛР на
бьющемся сердце и развитие хирургии КА без ИК позволили объединить вместе эти
процедуры [53, 69, 166, 168, 185].
Наибольшим опытом выполнения ТМЛР в
сочетании с АКШ на работающем сердце обладает N. Trehan из медицинского центра
в Дели, Индия. Он сообщил о 56 больных, которым была выполнена ТМЛР в сочетании
с шунтированием одной или двух КА на работающем сердце [186]. Подобная тактика
применялась у больных, у которых использование искусственного кровообращения
из-за наличия сопутствующих операций или очень тяжелого поражения аорты не
представлялось возможным. Периоперационная летальность составила 1,8%. Авторы
считают методику не только технически выполнимой, но и достаточно безопасной, с
отличными непосредственными результатами.
В последнее время расширяются
показания для применения лазерной реваскуляризации [66, 79, 129, 130].
Появились сообщения об успешных операциях ТМЛР у больных с атеросклерозом КА
после пересадки сердца. В госпитале Св. Луки в Милуоки 2 больным с
трансплантированным сердцем выполнены ТМЛР и ТМЛР в сочетании с АКШ. Оба
больных выжили, отмечено снижение ФК стенокардии (NYHA) с IV до II и повышение
ФВ ЛЖ с 29 до 52% в первом случае и с 20 до 56% во втором [66, 162].
Таким образом, ТМЛР в сочетании с АКШ
является достаточно новым и эффективным методом реваскуляризации миокарда,
который наряду с АКШ и ТЛБАП играет важную роль в лечении больных ИБС. Вместе с
тем, как сама методика, так и трактовка результатов требуют дальнейшей
разработки. Недавно А.А. Хелимским была защищена кандидатская диссертация
«Непосредственные и среднеотдаленные результаты ТМЛР у больных ИБС» [26], в
которой проанализирован опыт выполнения изолированных процедур ТМЛР в нашем
Центре. Но в последние годы число сочетанных операций ТМЛР с методами прямой
реваскуляризации в нашем Центре, как и во всем мире, неуклонно растет. Анализ результатов
сочетанных операций в отечественной литературе отсутствует. В нашем Центре, уже
в процессе написания настоящей работы была выпущена первая в стране монография
под редакцией академика Л.А. Бокерия, И.И. Беришвили, Ю.И. Бузиашвили, И.Ю.
Сигаева «Трансмиокардиальная лазерная реваскуляризация» [4], в которой обобщен
мировой опыт применения ТМЛР, описаны результаты операций с применением ТМЛР в
нашем Центре. Однако, ряд вопросов, касающихся выполнения сочетанных операций,
на момент выхода в свет монографии еще не был проанализирован. Не были
определены методики оценки повреждения миокарда при операциях с ТМЛР, не были
даны рекомендации по количеству перфорационных отверстий при выполнении разных
видов ТМЛР. Не до конца был проведен анализ осложнений и летальности.
Все это определило выбор цели нашего
исследования: изучить непосредственные результаты сочетанных операций ТМЛР и
АКШ у больных ИБС.
ГЛАВА II. МАТЕРИАЛ И
МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Общая
характеристика больных
С апреля 1997 года по январь 2002 года в лаборатории
трансмиокардиальной лазерной реваскуляризации (зав. лабораторией – профессор
И.И. Беришвили), клинико-диагностическом отделении (зав. отделением – профессор
Ю.И. Бузиашвили) и отделении хирургического лечения сочетанных поражений коронарных
и периферических артерий (зав. отделением – д.м.н. И.Ю. Сигаев) Научного Центра
сердечно-сосудистой хирургии им. А. Н. Бакулева РАМН (дир. – академик РАМН Л.А.
Бокерия) 165 больным ИБС выполнена операция трансмиокардиальной лазерной
реваскуляризации в изолированном виде или в сочетании с каким-либо методом
прямой реваскуляризации миокарда (ТЛБАП, АКШ, МИРМ).
Все больные были
распределены на следующие группы:
1
группа —
изолированные операции ТМЛР (n=70);
2
группа — операции
ТМЛР в сочетании с другими методами реваскуляризации миокарда (ТЛБАП, МИРМ,
АКШ) (n=95).
Распределение материала
по группам представлено на схеме 1.
Схема 1. Распределение
больных на группы

Распределение больных по видам выполненных
вмешательств и типам используемых лазеров представлено на схеме 2.
СО2 лазер был использован в 135 случаях (81.8%), из
них самостоятельно ТМЛР выполнена 52 больным (31.5%), в сочетании с ТЛБАП —
одному больному (0.6%), 66 больным (40%) — в сочетании с АКШ, в сочетании с
МИРМ — 17 больным (10.3%) (схема 2). В среднем во время одной операции
изолированной ТМЛР создавалось 29.4±5.9 каналов по передней, переднебоковой, боковой стенке ЛЖ, а
так же в области верхушки. В случае же сочетания ТМЛР с методами прямой
реваскуляризации миокарда этот показатель составил 22.1±4.8 каналов.
Эксимерный (XeCl) лазер
был применен в 30 случаях (18.2%): у 10 больных (6.1%) совместно с АКШ, у двух
больных (1.2%) — вместе с МИРМ, у остальных больных (10.9%) ТМЛР использована в
качестве единственной процедуры реваскуляризации миокарда. Количество
перфораций свободной стенки ЛЖ составило в среднем 21,3±1,64, межжелудочковой перегородки –
5,8±0,82. Следует подчеркнуть, что
конструктивная особенность XeCl лазера и форма передачи импульса позволяет
осуществлять перфорацию МЖП, что является одним из достоинств указанного
лазера.
Распределение
интегрированных с АКШ или МИРМ операций по числу кондуитов и их типу
представлено на рисунке 1.
Всего было выполнено 257
анастомозов с коронарными артериями, в среднем 2.71 на больного. Левая
внутренняя грудная артерия, выделенная скелетизированно, использована в 94
(98.9%), лучевая артерия – в 47 (49.5%) случаях. В одном случае пришлось
отказаться от использования ЛВГА вследствие погрешностей при ее выделении.
Кроме того, в 124 случаях в качестве кондуита использована большая подкожная
вена.
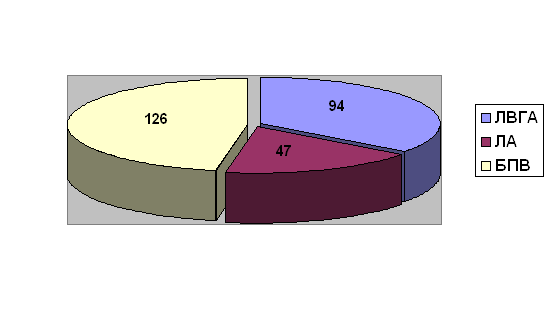
Рис. 1. Распределение
интегрированных с АКШ или МИРМ операций по числу кондуитов и их типу. ЛВГА –
левая внутренняя грудная артерия, ЛА – лучевая артерия, БПВ – большая подкожная
вена
В таблице 1 приведено
распределение больных по количеству шунтированных коронарных артерий.
Таблица 1. Распределение больных по количеству шунтированных коронарных
артерий
| Типы вмешательств | Количество больных n (%) |
| АКШ — 1 | 11(11.6) |
| АКШ — 2 | 26(27.4) |
| АКШ — 3 | 41(43.2) |
| АКШ — 4 | 17(17.9) |
| Всего | 95 (100) |
Передняя межжелудочковая
ветвь левой коронарной артерии (ПМЖВ) шунтирована с помощью ЛВГА в 93 (97.9%)
случаях. В одном случае с помощью ЛВГА была шунтирована диагональная ветвь
левой коронарной артерии (ДВ). По данным коронарографии ПМЖВ у этого больного
была диффузно изменена, окклюзирована в дистальной трети и на границе средней и
дистальной трети выявлялся субтотальный стеноз. Кроме того, у данного больного
выявлено аномальное отхождение огибающей ветви (ОВ) левой КА от правого
коронарного синуса. У одного больного (после погрешностей при заборе ЛВГА) ПМЖВ
шунтирована с помощью лучевой артерии. Диагональная ветвь шунтирована в 6
(6.3%) случаях. Шунтирование ДВ дважды выполнено лучевой артерией, в 4-х
случаях использована большая подкожная вена и однократно – ЛВГА. Шунтирование
ветви тупого края сердца (ВТК) выполнено у 78 (82.1%) больных (в 7-ми случаях
использована лучевая артерия, в 71-ом – большая подкожная вена). Правая
коронарная артерия была шунтирована у 43 (45.3%) больных. Аутовенозные шунты к
правой коронарной артерии использовались в 6-ти случаях, а лучевая артерия в
37-ми случаях. У 54 больных кроме того, шунтировали заднюю межжелудочковую
ветвь, при этом во всех случаях были использованы аутовенозные кондуиты. Таким
образом, «стандартная» операция [3] с использованием хотя бы одного
артериального шунта выполнена в 100 процентах случаев, в 33.7% случаев (32
пациента) использовано 2 и более артериальных кондуита. Переднюю стенку ЛЖ и
ПКА чаще шунтировали с помощью артериальных кондуитов, заднюю стенку ЛЖ – с
помощью венозных трансплантатов.
У подавляющего
большинства больных операция на сердце выполнялась впервые, двум больным (1.2%)
реваскуляризацию миокарда с помощью ТМЛР в сочетании с АКШ выполнили в качестве
повторного вмешательства.
Средний возраст больных первой группы колебался от 41
до 78 лет и, в среднем, составил 55.2±8.9 лет. Распределение больных по возрасту и полу в группе 1
представлено в таблице 2.
Таблица 2. Распределение больных по полу и возрасту (1
группа)
| Пол | Возраст | Всего: | ||||||
| 40-50 | % | 50-60 | % |
Старше 60 лет
|
% | n | % | |
| Мужчины | 11 | 15.7 | 22 | 31.4 | 29 | 41.4 | 62 | 88.6 |
| Женщины | 1 | 1.4 | 4 | 5.7 | 3 | 4.3 | 8 | 11.4 |
| Итого: | 70 | 100% | ||||||
Распределение больных второй группы по полу и возрасту
представлено в таблице 3. Средний возраст больных этой группы составил 57.2±7.3 лет и колебался от 40 до 69 лет.
Таблица 3. Распределение больных по полу и возрасту (2
группа).
| Пол | Возраст | Всего: | ||||||
| 40-50 | % | 50-60 | % |
Старше 60 лет
|
% | n | % | |
| Мужчины | 14 | 14.7 | 35 | 36.8 | 37 | 39.0 | 86 | 90.5 |
| Женщины | 1 | 1.1 | 5 | 5.2 | 3 | 3.2 | 9 | 9.5 |
| Итого: | 15 | 15.8 | 40 | 42.1 | 40 | 42.1 | 95 | 100 |
Таким образом, в обеих группах большинство больных
составили мужчины, преимущественно в возрасте старше 50 лет.
Диагноз ИБС был поставлен всем больным при поступлении
в НЦ ССХ им. А.Н. Бакулева РАМН на основании жалоб, анамнеза, клиники
стенокардии напряжения и/или покоя, объективных дополнительных методов
обследования. С целью определения функционального класса стенокардии
использована классификация CCS (Canadian Cardiovascular Society angina classification) [40], представленная в таблице 4.
Таблица 4. Классификация стенокардии.
|
КЛАСС
|
CCS |
| I | Обычная физическая активность, например, прогулка или подъем по ступеням не вызывает приступа стенокардии. Приступ возникает при напряженной, либо пролонгированной, либо быстрой нагрузке во время работы или отдыха. |
| II | Небольшие ограничения обычной активности. Быстрая ходьба или подъем по ступеням, ходьба в гору, ходьба или подъем по ступеням после еды, на холоде или ветре, или во время стресса, а так же в течение нескольких часов после сна. Ходьба более 2-х кварталов или подъем более одного лестничного пролета в нормальном ритме и в обычных условиях. |
| III | Выраженные ограничения обычной физической активности. Ходьба на 1-2 квартала, подъем на один лестничный пролет в обычных условиях. |
| IV | Неспособность выполнять любую физическую нагрузку без наступления дискомфорта. Симптомы стенокардии могут присутствовать в покое. |
Распределение больных по функциональному классу в
обеих группах, согласно классификации CCS, приведено в таблицах 5, 6.
Как видно из таблиц подавляющее большинство больных
обеих групп находились в III и
IV функциональном классе (100% больных 1-ой группы и 97.9% больных 2-ой
группы).
У 2 (2.9%) пациентов первой группы и у 6 (6.3%)
больных второй группы при поступлении имелась клиника нестабильной стенокардии.
Этим больным проводилась интенсивная антиангинальная терапия с целью
стабилизации состояния, после чего было выполнено оперативное вмешательство.
Таблица 5. Распределение больных согласно
функциональному классу стенокардии (1 группа)
| Функциональный класс |
CCS
|
|
| Всего | % | |
| I | — | — |
| II | — | — |
| III | 29 | 41.4 |
| IV | 41 | 58.6 |
Таблица 6. Распределение больных согласно
функциональному классу стенокардии (2 группа)
| Функциональный класс |
CCS
|
|
| Всего | % | |
| I | — | — |
| II | 2 | 2.1 |
| III | 52 | 54.7 |
| IV | 41 | 43.2 |
2.2 Лазерные установки
Всем больным выполнена трансмиокардиальная лазерная
реваскуляризация миокарда, как в качестве единственного метода лечения (n=70), так и в сочетании с АКШ (n=95), в том числе, выполненным по
малоинвазивной методике (n=19). ТМЛР выполняли при помощи отечественного 500 Вт
СО2 лазера «Геном — 4» (n=135)
и эксимерного XeCl лазера MAX 20 TMLR фирмы AutoSuture (n=30).
Отечественная установка представляет собой одномодовый
углекислотный лазер, работающий в импульсном и непрерывном режимах. Лазерное
излучение в виде пучка диаметром 7 мм через оптический манипулятор подается от
блока генерации к зоне воздействия. Манипулятор снабжен линзой, фокусирующей пучок
до 0,2 мм. Лазер производит импульс длительностью 30-50 мсек., за это время
доставляется энергия 25-40 Дж. Система управления установкой по команде хирурга
подает ЭКГ-синхронизированный импульс лазерного излучения с заданными
параметрами по мощности, длительности импульса и задержки от комплекса QRS.
Лазерный импульс подается в момент абсолютной рефрактерности сердечной мышцы в
сегмент ST (после окончания комплекса QRS до начала зубца T). ЭКГ-синхронизация
позволяет предотвратить возможные нарушения ритма, связанные с воздействием на
миокард.
Эксимерный лазер MAX 20 TMLR представляет собой
пульсирующий XeCl лазер, испускающий лазерное излучение с длиной волны 308 нм и
мощностью 40 мДж. Длительность импульса составляет 250 нсек. Параметры данного
излучения позволяют использовать гибкое фиброволокно для доставки излучения к
поверхности миокарда. Кроме этого рукоятка лазера так же имеет возможность
изменять кривизну до 450 и позволяет пенетрировать задне-боковые и задние
отделы сердца, а так же МЖП. Перфорация всей стенки миокарда происходит за 7-10
импульсов, поэтому аппарат не имеет синхронизации с ЭКГ пациента.
2.3 Методики исследования
Общеклинические методы исследования, помимо сбора
анамнестических данных и физикального обследования, включали в себя: электрокардиографию,
холтеровское мониторирование, эхокардиографию с анализом сегментарной
сократимости миокарда, велоэргометрию, методики стресс-ЭхоКГ, селективную
коронарографию, левую вентрикулографию, радионуклидные методики, биохимические
исследования крови и морфологическое исследование материала вскрытий.
2.3.1 Электрокардиографическое
исследование
Регистрацию электрокардиограммы проводили на аппаратах
Sicard 440, 460 фирмы “Siemens” в 12 стандартных отведениях с анализом ритма
сердца, нарушений проводимости, локализации ишемических изменений миокарда.
Электрокардиографическое исследование проводилось при
поступлении, в динамике, перед проведением коронарографии и операции, ежедневно
в раннем послеоперационном периоде, а затем при обследовании больных в
отдаленном периоде. В палате реанимации после операции проводился постоянный
ЭКГ-мониторинг. Исследование проведено всем 100% больным.
2.3.2 Холтеровское мониторирование
Суточное ЭКГ-мониторирование
проводили с использованием комплекса «New Wave 4.1» фирмы «Hewlett Packard»
(США). Регистрировали два отведения — VI и V5 в течение 24 часов. Также в течение суток пациент вел
дневник субъективных ощущений и выполняемых физических нагрузок. При
расшифровке записи ЭКГ оценивали появление ишемических изменений на ЭКГ и/или
нарушений ритма.
2.3.3 Эхокардиография
(ЭхоКГ)
Эхокардиографию проводили
на аппаратах Марк — 5« (Голландия) и »Sonos — 1500, 2500, 5500« фирмы »Hewlett-Packard» (США). Для расчета региональной и глобальной
сократимости левого желудочка была использована компьютерная программа «Ultra Medic Promed». При анализе эхокардиограмм рассматривали общую
фракцию выброса левого желудочка (ОФВ), нарушение локальной сократимости,
конечно-систолический размер (КСР), конечно-диастолический размер (КДР),
конечно-систолический объем (КСО), конечно-диастолический объем (КДО), наличие
аневризмы, тромба в полости ЛЖ, а также состоятельность аортального клапана.
При плохой визуализации
полости ЛЖ из трансторакального доступа или атероматозе восходящей аорты
проводили чреспищеводную Эхо КГ по общепринятой методике с использованием
чреспищеводного мультипланового датчика «Omniplane» фирмы «Hewlett-Packard» (США). Контроль сегментарной сократимости
проводили и в раннем послеоперационном периоде.
Клапанную регургитацию
определяли как ретроградный поток, занимающий не менее половины фазы сердечного
цикла. Тяжесть регургитации оценивали по объему распространения турбулентного
потока.
Исследование проведено
всем больным.
2.3.4 Велоэргометрия (ВЭМ)
Велоэргометрию проводили
на велоэргометре фирмы «Siemens»
по принятой в НЦ ССХ им. А. Н. Бакулева методике непрерывной ступенчато
возрастающей дозированной физической нагрузки в течение 3 минут на каждой
ступени. Проводили запись ЭКГ и контроль АД в покое до начала исследования, на
последней минуте каждой ступени, а также сразу после прекращения нагрузки на 2,
4, 6 минутах восстановительного периода вплоть до нормализации ЭКГ. Нагрузку
прекращали при достижении 85% максимального ритма, а также при развитии
приступа стенокардии, появлении желудочковых экстрасистол, нарушении
проводимости, появлении горизонтального или косого смещения сегмента ST более чем на 1 мм, инверсии зубца Т,
углублении или появлении зубца Q,
подъема АД более 230 мм. рт. ст., снижение АД на 25% от исходного уровня,
выраженной одышки. Проба расценивалась как положительная при возникновении
приступа стенокардии, горизонтальном или косонисходящем снижении сегмента ST на
1 мм и более от изолинии, подъем сегмента ST на 1 мм и более. В зависимости от
выполнения максимальной физической нагрузки толерантность оценивали как очень
низкую при 25 Вт, низкую — 50 Вт, среднюю — 100 Вт; 125Вт и выше – определяли
как высокую толерантность к физической нагрузке.
Пробу не проводили
больным с нестабильной стенокардией, в течение 3-х месяцев после перенесения
острого инфаркта миокарда или нарушения мозгового кровообращения, при грубых
остаточных явлениях после нарушения мозгового кровообращения, при
недостаточности кровообращения II Б ст., ишемии нижних конечностей III ст.
ВЭМ выполнена 156 (94.5%)
пациентам. 8-ми больным не проводилось исследование в связи с клиникой
нестабильной стенокардии при поступлении, один пациент перенес травматическую
ампутацию ноги в 29-ти летнем возрасте.
2.3.5 Коронароангиография (КГ),
вентрикулография (ВГ)
Коронарографическое
исследование проводили на ангиографических установках «Angioscope D» фирмы «Siemens» (Германия), «Integris 3000» фирмы «Philips» (Голландия) по методу М. Judkins и Sones. Для контрастирования КА использовали омнипак
300-350. КГ ЛКА выполняли в стандартных проекциях по методике Gensini: правая косая 150 и 450, левая косая
проекция 600, левая боковая 900. В некоторых случаях использовали
дополнительные проекции: левая передняя косая 450-750, каудокраниальная 300.КГ
ПКА выполняли в стандартных проекциях: правой косой 450, левой косой 600, левой
боковой 900 от сагиттальной оси. Анализ коронарограмм осуществляли на
просмотровом аппарате «Tagarno
35AX». При анализе коронарограмм
определяли тип кровоснабжения сердца, состояние основного ствола ЛКА, степень и
уровень поражения коронарных артерий, диаметр коронарных артерий, количество
пораженных артерий, наличие коллатерального кровотока.
Коронарография выполнена
всем больным. Всем больным выполнена ангиография левой внутренней грудной
артерии.
Вентрикулография выполнена в правой косой проекции 12
пациентам. Расчет ФВ ЛЖ производили по методу В. W. Gilbert (1976).
Контрактильность
оценивалась по баллам (в передне-базальном, переднелатеральном, апикальном,
диафрагмальном, задне-базальном сегментах): 1 — норма, 2 — умеренный гипокинез,
3 — выраженный гипокинез, 4 — акинез, 5 — дискинез. Индекс асинергии ЛЖ
измеряли по баллам в сегментах с помощью программы «Contron». В связи с малым количеством
исследований мы не приводим распределения выявленных изменений у больных обеих
групп.
2.3.6 Стресс —
эхокардиография
Ультразвуковые
исследования выполняли на аппаратах “Sonos — 2500”
и “Sonos — 5500” фирмы Hewlett-Packard
(США). Анализ регионарной сократимости проводили в 18 сегментах ЛЖ.
Полуколичественную оценку кинетики стенок ЛЖ осуществляли с использованием
общепринятой 4-балльной системы, где за 1 балл принимался нормокинез, за 2 –
гипокинез, за 3 – акинез и 4 — дискинез.
Стресс-эхокардиографию
проводили после предварительной отмены антиангинальных препаратов за 24 ч до
исследования и бета-блокаторов — за 36 ч. При возникновении приступов
стенокардии за этот период больные пользовались нитратами короткого действия
(нитроглицерином, изокет-спреем). Регистрацию ЭхоКГ-данных проводили исходно (I
этап), при максимальном увеличении сократимости (II
этап), появлении локальной асинергии и/или снижении сократимости (III
этап) и после окончания пробы в стадии восстановления. В качестве критерия
жизнеспособности на II этапе
рассматривалось улучшение кинетики миокарда со снижением диссинергии на 1 балл
больше, чем в 1 сегменте ЛЖ.
2.3.6.1
Сресс-ЭхоКГ с ВЭМ
Пробу
с дозированной физической нагрузкой выполняли на велоэргометре “Medtronic”
фирмы Hellige (Германия) и “Sicard”
фирмы Siemens (Германия). ВЭМ
проводили в положении сидя по стандартному протоколу, принятому в НЦССХ им.
А.Н. Бакулева и описанному выше. После первой ступени нагрузки или при
увеличении ЧСС на 10-20 уд/мин регистрировали ЭхоКГ в положении сидя (II
этап). Сократительную функцию также оценивали при окончании пробы на пике
нагрузки или во время первой минуты восстановления в горизонтальном положении (III
этап).
2.3.6.2
Стресс-ЭхоКГ с добутамином
Стресс-ЭхоКГ
с добутамином проводили с внутривенной инфузией препарата в начальной дозе 5
мкг/кг/мин в течение 3 мин с постепенным увеличением дозы до 10, 15, 20, 30 и
40 мкг/мин каждые 3 мин. В конце каждой ступени регистрировали ЭхоКГ в 4
позициях с дальнейшим анализом на компьютере по программе “Ultra
Magic Promed”.
Анализ локальной сократимости проводили исходно (в состоянии покоя), на малых
дозах добутамина при максимальном увеличении сократимости и на высоких дозах
добутамина (при развитии ишемии).
Стенки левого желудочка,
выявляющие улучшение функции при малых дозах добутамина и становящиеся гипо-
или акинетичными при инфузии больших доз добутамина определяли как области с
зонами риска ишемии. Зоны же, которые акинетичны или дискинетичны и не меняют
кинеза при стимуляции допамином, определяли как рубцовую ткань. Кроме того,
оценивали толщину и систолическое утолщение стенок сердца.
Рубцовая зона, как
известно, представляет собой истонченный некротизированный миокард.
Жизнеспособная же стенка характеризуется систолическим утолщением. На этих
принципах построена дополнительная индентификация жизнеспособности миокарда —
толщина стенки и систолическое утолщение являются характерными признаками
жизнеспособного миокарда.
У больных со сниженной ФВ
ЛЖ, определение зон обратимой ишемии миокарда приобретает решающее значение.
Больные с низкой ФВ ЛЖ в основном за счет рубца не могут рассматриваться как
кандидаты на ТМЛР.
2.3.6.3 ЭхоКГ с
нитроглицерином
ЭхоКГ с нитроглицерином проводили
с использованием двух таблеток нитроглицерина (НГ) сублингвально. ЭхоКГ
регистрировали в покое и после приема нитроглицерина. Оценивали изменение зон
ассинергии миокарда, ОФВ. Стресс-эхокардиогафические методики выполнены всем
больным.
2.3.7 Радионуклидные
методы исследования
2.3.7.1 Планарная
сцинтиграфия миокарда (ПСЦМ) с 201Tl
С целью определения
жизнеспособности миокарда (наличие обратимых и необратимых дефектов перфузии)
все больные были обследованы до операции. Для определения жизнеспособности
миокарда ПСЦМ с 201Tl выполнялась в
покое, либо в сочетании с нагрузочными тестами. Использовались следующие
протоколы исследования:
1) ПСЦМ в покое +
регистрация ранних (через 3 часа) и поздних (через 24 часа) отсроченных
изображений;
2) ПСЦМ в сочетании
с нагрузочными тестами + регистрация ранних (через 3 часа) отсроченных
изображений и в случае необходимости поздних (через 24 часа) отсроченных изображений.
В
качестве стресс-тестов применяли нагрузочную велоэргометрию, которую проводили
по стандартной методике с общепринятыми критериями прекращения нагрузки
(возникновение приступов стенокардии или появление признаков ишемии на ЭКГ) и
чреспищеводную электростимуляцию (ЧПЭС) левого предсердия.
ЧПЭС
проводили в кабинете функциональной диагностики в положении больного лежа на
спине. Регистрацию ЭКГ проводили до стимуляции, каждую минуту нагрузки и спустя
30 с после ее окончания. Пробу прекращали при появлении горизонтальной или
косонисходящей депрессии ST не менее 0,2 мВ в момент
стимуляции с обязательным сохранением депрессии ST на 0,1 мВ в первых трех спонтанных циклах ЭКГ с
длительностью снижения не менее 0,08 с от точки “I” [Н. И. Филоненко, 1991].
201Tl вводили на пике нагрузки,
внутривенно, болюсно, активностью 74 МБк. Визуализацию перфузии миокарда
начинали через 10 минут после введения в покое и через 5-7 минут после введения
во время нагрузочной пробы.
ПСЦМ выполняли на
гамма-камере “Ohio-Nuclear” (США). Исследование проводили в трех стандартных
проекциях: передней, левой передней косой под углом 450 и левой боковой 900.
Обработка и анализ изображений проводились с применением визуальной и
количественной оценки сцинтиграмм. Количественная обработка данных проводилась
на компьютере МСs — 560 фирмы “Technicare” (США) по программе, разработанной в
лаборатории радионуклидных методов исследования НЦ ССХ им. А. Н. Бакулева РАМН
[О. Г. Облавацкая, 1985] и параллельно на компьютере 486/НP с клинической программой
“Голд-Рада”.
При анализе сцинтиграмм
оценивали распределение миокардиальной активности РФП по отделам левого
желудочка (15-ти его сегментов), перераспределение и вымывание таллия.
Сегменты миокарда, в
которых исходно определялось снижение аккумуляции РФП, а на отсроченных
сцинтиграммах вследствие перераспределения 201Tl включали РФП, считали жизнеспособными.
Сегменты миокарда, в
которых на исходных сцинтиграммах (в покое или после нагрузки) регистрировалось
снижение аккумуляции 201Tl, и
которые не включали 201Tl при
регистрации ранних (3 часа) и поздних (24 часа) отсроченных изображений,
считали нежизнеспособными.
Состояние
миокарда оценивали по 5-балльной шкале: 4 — норма, 3 — ишемия (гибернированный
миокард), 2 — мелкоочаговые рубцовые изменения, 1 — рубец, 0 — аневризма.
2.3.7.2 Однофотонная
эмиссионная компьютерная томография миокарда (ОФЭКТ)
ОФЭКТ миокарда
проводилась по однодневному протоколу: физическая нагрузка (велоэргометрия) —
перераспределение радиофармпрепарата (РФП) через 4 часа. Ступенчатая ВЭМ
проводилась по общепринятой методике с непрерывным контролем ЭКГ, частоты
сердечных сокращений и артериального давления. Тест выполняли до появления
одного из стандартных критериев прекращения нагрузки. 201Tl (111 МВк) вводили
внутривенно на пике нагрузки, после чего пациенты продолжали выполнять
максимальную нагрузку в течение минуты (при необходимости ступень нагрузки
снижали). Исследование проводили натощак (голод не менее 6 часов). За 24 часа
до исследования всем пациентам отменяли антиангинальную терапию (антагонисты
кальция, нитраты) и за 48 часов — медикаменты с пролонгированным
антиангинальным эффектом (бета-блокаторы). Запись изображений начинали спустя
7-10 минут после введения РФП, при настройке гамма-камеры на фотопик излучения
201Tl (68-80 кэВ) с шириной энергетического окна дифференциального
дискриминатора 20%. Для оценки скорости вымывания 201Tl через 4 часа после
инъекции РФП проводили повторную запись в тех же условиях, что и первоначальное
исследование. При наличии необратимых дефектов перфузии на исходных и ранних
отсроченных изображениях с целью идентификации жизнеспособного миокарда в зоне
дефекта перфузии проводили дополнительное исследование с реинъекцией 201Tl (55 МБк). Запись осуществляли на
двухголовочной ротационной гамма-камере («Vertex», «ADAC», США) с углом между
детекторами в 90о.
Реконструкцию срезов
миокарда ЛЖ осуществляли по стандартной томографической программе (AutoSPECT
Plus), используя фильтр Баттерворта. Для визульного анализа использовали
томографические срезы, по короткой, длинной вертикальной и длинной
горизонтальной осям миокрада ЛЖ. Для количественного анализа томосцинтиграмм
использовали метод полярного картирования реконструированного томографического
изображения миокарда (“бычий глаз”) (программа “Autoqvant”). На полярной диаграмме, где миокард левого
желудочка разбивался на 20 сегментов, автоматически выявлялась область
(сегмент) с максимальной аккумуляцией РФП. Все остальные сегменты
нормализовывались относительно максимального.
В зависимости от
степени нарушения перфузии все сегменты миокарда в исходном исследовании были
классифицированы в 4 группы (табл. 7): 0 — нормально перфузируемые сегменты, с
уровнем накопления РФП на нагрузочном изображении более 75% от максимального; 1
– сегменты с умеренным снижением перфузии (51-74%); 2 – сегменты со
значительным снижением перфузии (30-50%) и 3 – сегменты с выраженным снижением
перфузии с уровнем накопления РФП менее 30% от максимального.
Таблица 7. Классификация
сегментов миокарда ЛЖ по степени нарушения перфузии
| Группы | Степень нарушения перфузии | Накопление РФП (%) |
| на нагрузке | ||
| 0 | нормальная перфузия | > 75 |
| 1 | умеренное снижение перфузии | 51-74 |
| 2 | значительное снижение перфузии | 30-50 |
| 3 | выраженное снижение перфузии | < 30 |
Для верификации данных
сцинтиграфии, в Центре [5], была разработана оригинальная схема, на которой
сопоставлялись данные коронарографии и сцинтиграфии посегментно у каждого
больного (рис. 2).
Рис. 2. А. Схема расположения
сегментов миокарда ЛЖ и их кровоснабжение
В. Схема расположения
сегментов миокарда ЛЖ в соответствии с локализацией зон лазерного воздействия.
Зона лазерного воздействия обозначена розовым цветом. Красным цветом пронумерованы
«леченные», зеленым – «смежные» и голубым – «нелеченные» сегменты миокарда ЛЖ.
Сокращения: ЛКА – левая
коронарная артерия, ПКА – правая коронарная артерия, ПМЖВ – передняя
межжелудочковая ветвь, ДВ – диагональная ветвь, ОВ – огибающая ветвь, ВТК –
ветвь тупого края, ЗБВ ЛЖ – задне-боковая ветвь ЛЖ, ЗМЖВ – задняя
межжелудочковая ветвь
Исходя из
комбинированной коронаро-сцинтиграфической оценки полярных диаграмм мы
производили топическую реваскуляризацию миокарда, выработанную на основе
анализа полярных диаграмм. Каждая из зон хирургического воздействия полярных
диаграмм отмечалась на указанной схеме. Кроме того, с целью топической оценки
изменений перфузии миокарда после операции указанная схема анализировалась на
всех этапах в послеоперационном периоде.
Как уже отмечалось,
индивидуальные зоны лазерного воздействия были нанесены на полярные диаграммы.
В соответствии с локализацией зон лазерного воздействия сегменты были
классифицированы на 3 категории: 1 — “леченные” – это
сегменты, непосредственно подвергшиеся лазерному воздействию; 2 — “смежные”-
сегменты, прилежащие к зоне лазерного воздействия; 3 — “нелеченные”
— сегменты, отдаленные от зоны лазерного воздействия.
Всего выполнено 176
ОФЭКТ-исследований, проанализировано 3520 миокардиальных сегментов.
2.3.7.3 ЭКГ-синхронизированная
томосцинтиграфия (Gated—SPECT) миокарда
Выполнялась по
однодневному протоколу с внутривенным введением двух изотопов: 2,5 mCi 201Tl — в покое и 20 mCi 99mTc-тетрофосмина (Myoview) — при нагрузке (через 4 часа).
Эта методика дает
возможность за одно исследование наряду с перфузионными сцинтиграммами получить
компьютеризированную сегментарную количественную оценку накопления РФП в
миокарде, выявить зоны (в процентах) обратимого и необратимого миокарда и
дополнительную достоверную диагностическую информацию о сократительной
способности ЛЖ (ФВ ЛЖ и его объемы). Определение ФВ ЛЖ производится по объемным
контурам ЛЖ в диастолу и систолу с использованием программы AutoQuant Медицинского Центра Седар-Синай
(Эмори, США).
Программа позволяет
визуализировать томосцинтиграммы в покое и нагрузке, дефекты накопления РФП при
нагрузке и в покое, а также выявлять зоны обратимых изменений в миокарде, и на
трехмерной модели левого желудочка четко идентифицировать локализацию зон
ишемизированного миокарда. Кроме того, по материалам исследования, проведенного
по данному протоколу во всех случаях можно выделить зоны ишемии (в процентах) в
конкретных отделах ЛЖ и процент обратимости этих изменений в каждом из них.
Помимо этого, по протяженности ишемизированного миокарда (в процентах) до и
после нагрузки представляется возможность дифференцировать ишемизированный и
гибернированный миокард от рубца.
2.3.8 Биохимические исследования
Проводилось исследование кардиомаркеров: тропонина Т,
серийное определение активности фермента креатинфосфокиназы (КФК), его МВ —
фракции в сыворотке крови в раннем послеоперационном периоде. Причем
учитывалось как абсолютное значение ферментов в ЕД/л, так и процентное
повышение изофермента МВ от общей активности КФК. Принимался во внимание и
расчет суммарного выброса как общей КФК, так и ее изоформы. Забор крови на КФК
МВ проводился у больных после операции в динамике шестикратно с интервалом 3
часа. Пробы крови брали из вены в течении 16-24 часов. Если активность МВ КФК к
этому времени не имела тенденции к возрастанию, то забор крови продолжали до
тех пор, пока показатели не снижались до величин, близких к норме.
Активность КФК и КФК МВ
определяли спектрофотометрическим методом на биохимических анализаторах крови
«Техникон» РА — 1000» и «4 Кобас Мира плюс» фирм «Байер» и «Рош-Москва»,
соответственно.
Для обеспечения максимальной точности исследования
ежедневно проводили контроль качества, тестируя коммерческие контрольные
сыворотки.
Для определения сердечного тропонина Т (сТрТ)
использовали качественный метод регистрации с помощью тест–полоски «Троп-Т»
(фирмы «Boehringer – Mannheim»).
Тест проводили на планшетке с адсорбированными
моноклональными антителами двух видов, специфичными для cTрT. Перекрестное реагирование с тропонином Т скелетных мышц в
данном тесте составляет 0%.
Для диагностики
использовалась гепаринизированная кровь в количестве 150 мкл. Результаты
оценивали в течение 20 мин. При этом в случае содержания тропонина в крови 0.1
мг/мл и более отмечалась появление двух окрашенных линий (контрольной и
индикаторной). При отрицательном результате – только контрольной. Метод
позволяет судить об уровне тропонина, поскольку появление окрашивания второй
полоски зависит от концентрации полипептида в исследуемой крови: при уровне cTрT 20 мкг\л положительный результат выявляется через 1 мин, а
при концентрации 2 мкг\л — через 4 мин.
В норме у здоровых людей даже после чрезмерной
нагрузки уровень cТрT не превышает 0,5 мкг\л. Поэтому
обнаружение его уровня выше этого предела свидетельствует о поражении сердечной
мышцы.
Положительный результат означает, что имелось
повреждение кардиомиоцитов.
Анализы общей КФК и КФК МВ выполнены 20-ти (28.6%)
пациентам первой группы (изолированные операции ТМЛР), 72-м (75.8%) больным
второй группы (операции ТМЛР в сочетании с АКШ или МИРМ), всего выполнено 1104
анализа. Уровень сердечного тропонина Т оценивали у 10 (1.4%) пациентов с
изолированной ТМЛР и у 20 (21.1%) пациентов после сочетанных операций.
Диагноз инфаркта миокарда выставлялся на основании:
1.
Изменений на ЭКГ
[появление новых зубцов Q,
отсутствующих на дооперационных ЭКГ и/или уменьшение амплитуды зубцов R(> 25%) по крайней мере, в двух
отведениях].
2.
Повышение КФК МВ
(при одновременном повышении общей КФК) и соотношении КФК МВ/КФК более 10%.
Во всех случаях, когда был проведен тропониновый тест,
совпадение положительного ответа с указанными изменениями позволяло
верифицировать диагноз ИМ. В остальных случаях при положительном тропониновом
тесте выставлялся диагноз «малого повреждения миокарда». Дальнейшую
дифференциацию диагноза МПМ проводили ретроспективно, по динамике изменения
данных на полярных диаграммах по данным сцинтиграфии.
Также проводился
биохимический анализ проб крови с целью определения газового и
кислотно-щелочного состояния, который выполнялся экспресс методом на аппарате
«CHIRON — DIAGNOSTIC» (Англия).
2.3.9
Гистологические и морфологические исследования
Мы исследовали сердца 5-ых
больных, оперированных при помощи ТМЛР и умерших на 9-28 сутки после операции (n=3) и на операционном столе (n=2).
Блоки ткани миокарда для
морфологического исследования были взяты из области лазерной перфорации
миокарда и обработаны двояким способом:
1. заключены в парафин;
2. заморожены при помощи охлажденного
до – 800 С петролейного эфира.
Приготавливали серийные
продольные и поперечные срезы миокарда в области ТМЛР. Депарафинированные срезы
и срезы, приготовленные в криостате при t = — 200 C, окрашивали гематоксилином и эозином, а также трехцветным
способом по Ван Гизону.
Исследования проводились на
фотомикроскопе «Ахioроt» фирмы Саrl Zеiss, окуляры РI 10х/25;
бинокулярная насадка 1х; объективы Рlаn- NEOFLUAR 2,5х/0,075; 10х/0,30;
20х/0,50; 40х/0,75. Микрофотосъемка осуществлялась в автоматическом режиме.
Морфометрия осуществлялась с
помощью сетки с равноудаленными точками для микроскопических стереометрических
исследований (при случайном совмещении счетного признака на 100 точках сетки) и
стереометрической линейки [1].
2.3.10 Статистическая обработка
Полученные данные обработаны на
компьютере с использованием пакета статистических программ «Биостат». Сравнение
средних показателей производили с помощью стандартных методов вариационной
статистики медико-биологического профиля. Для выявления существенных различий
между средними значениями различных совокупностей исходно сопоставляемых групп
больных применяли критерий Стьюдента. Данные считались статистически
достоверными при значении р<0,05. Зависимость между различными показателями
определяли путем корреляционного анализа. Сила связей оценивалась по величине
коэффициента корреляции: сильная — при r=0,7 и более, средняя — при r=0,3-0,7,
слабая — при r=0,3 и менее. Направленность связей оценивалась по знаку
коэффициентов корреляции.
ГЛАВА III. КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ.
ПОКАЗАНИЯ К ОПЕРАЦИЯМ, ТИПЫ ВЫПОЛНЕННЫХ ВМЕШАТЕЛЬСТВ
3.1 Клиническая
характеристика больных
В наше исследование вошли 165 больных ИБС, которым
была выполнена операция с использованием ТМЛР. Больные были распределены на две
группы (схема 1):
1
группа —
изолированные операции ТМЛР (n=70);
2
группа — операции
ТМЛР в сочетании с другими методами реваскуляризации миокарда (ТЛБАП, МИРМ,
АКШ) (n=95).
Как было представлено
выше (глава II) обе группы не отличались по
возрасту и полу (в обеих группах большинство больных составили мужчины,
преимущественно в возрасте старше 50 лет), подавляющее большинство больных
обеих групп находились в III и
IV функциональном классе (100% больных 1-ой группы и 97.9% больных 2-ой
группы).
По данным анамнеза 46 больных первой группы перенесли
инфаркт миокарда в разные сроки до операции (65.7% больных), подтвержденный
клинико-инструментальными методами исследования. В 19 случаях (27.1%)
отмечалось 2 и более инфаркта в анамнезе. Инфаркт миокарда в анамнезе у больных
2-ой группы выявлен в 66 случаях (69.5%).
Все больные для купирования приступов стенокардии
пользовались нитроглицерином. В среднем больные первой группы использовали в
сутки 10.2±5.3 табл.
нитроглицерина, больные второй группы – 9.1±7.1 табл. соответственно.
При обследовании у большинства пациентов, отнесенных к
первой группе, помимо измененных коронарных артерий имелось атеросклеротическое
поражение еще одного сосудистого бассейна. У 47 больных (67.1%) отмечено
поражение брахиоцефальных артерий, у 29 (41.4%) – синдром Лериша и поражение
сосудов нижних конечностей, у 8 (11.4%) – вазоренальная гипертензия,
обусловленная как атеросклеротическим поражением почечных артерий, так и их
аномалией, у 5 (7.1%) больных – синдром Такаясу. Частота сочетанного поражения
магистральных сосудов у больных второй группы достоверно не отличалась. Частота
сочетанного атеросклеротического поражения основных магистральных сосудов в
обеих группах больных представлена в таблице 8.
Таблица 8. Частота сочетанного атеросклеротического
поражения основных магистральных сосудов в различных группах больных.
Характер поражения |
Группы больных | |
|
1 группа n=70
|
2 группа n=95
|
|
| Поражение брахиоцефальных артерий | 29 (41.4%) | 45 (47.3%) |
| Синдром Лериша | 29 (41.4%) | 36 (37.9%) |
| Синдром Такаясу | 5 (7.1%) | 9 (9.5%) |
| Стенозы висцеральных ветвей брюшной аорты |
— | 1 (1.1%) |
|
Стенозы почечных Артерий
|
8 (11.4%) | 9 (9.5%) |
Кроме этого из сопутствующей патологии в обеих группах
у 119 больных (72.1%) отмечена артериальная гипертензия, у 16 больных (9.7%) –
сахарный диабет различной степени тяжести, у 59 (35.8%) – хронические
заболевания почек, у 2 (1.2%) – аневризма инфраренального отдела аорты. У 16
больных (9.7%) отмечены преходящие нарушения мозгового кровообращения, у 2-х —
в анамнезе инсульт, у 12 – явления дисциркуляторной энцефалопатии (табл. 9).
Таблица 9. Сопутствующая патология у больных, вошедших
в исследование
| Патология | Количество больных, n (%) |
| Артериальная гипертензия | 119 (72.1) |
| Сахарный диабет | 16 (9.7) |
| Хронические заболевания почек |
59 (35.8) |
| Аневризма инфраренального отдела аорты |
2 (1.2) |
| Преходящие нарушения мозгового кровообращения |
16 (9.7) |
| Инсульт в анамнезе | 2 (1.2) |
| Дисциркуляторная энцефалопатия |
12 (7.3) |
Анализ исходных электрокардиограмм выявил ишемические
изменения по передней, передне-перегородочной, передне-боковой, боковой стенкам
и верхушке ЛЖ у 24 больных (34.3%) первой группы и 35 (36.8%) больных второй
группы. У 11 (15.7%) больных первой группы и 18 (18.9%) больных второй,
ишемические изменения локализовались по задней, задне-диафрагмальной,
задне-боковой стенкам ЛЖ. Результаты анализа исходных электрокардиограмм
представлены в таблице 10.
Ни в одном случае не выявлено ЭКГ-признаков
постинфарктной аневризмы левого желудочка, что являлось бы противопоказанием к
операции ТМЛР.
Таблица 10. Результаты анализа исходных
электрокардиограмм.
| ЭКГ |
1 группа n=70
|
2 группа n=95
|
| Ишемические изменения по передней, передне-перегородочной, передне-боковой, боковой стенкам, верхушке ЛЖ |
24 (34.3%) | 35 (36.8%) |
| Ишемические изменения по задней, задне-диафрагмальной, задне-боковой стенкам ЛЖ |
11 (15.7%) | 18 (18.9%) |
| Нарушения внутрижелудочковой проводимости |
8 (11.4%) | 12 (12.6%) |
| Нарушения атриовентрикулярной проводимости |
6 (8.6%) | 7 (7.4%) |
| Гипертрофия миокарда ЛЖ | 18 (25.7%) | 23 (24.2%) |
Холтеровское мониторирование проведено 158 (95.8%)
больным. У 84 больных (50.9%) имелась желудочковая экстрасистолия различных
градаций по Lawn. Больным, у которых была выявлена ЖЭ III или IV
градаций в дооперационном периоде проводилось насыщение кордароном по схеме
принятой в НЦ ССХ им. А.Н. Бакулева РАМН.
Средняя фракция выброса
ЛЖ у больных, вошедших в первую группу, была 49.3±3.1% и колебалась в пределах от 20% до 61%. Больные,
включенные во вторую группу, имели среднюю фракцию выброса 52.1±4.9%, (40% — 69%). Недостаточность
аортального клапана 1-ой степени обнаружена у 11 (15.7%) пациентов 1-ой группы
и у 14 (14.7%) больных второй группы.
Общая фракция выброса у
одного пациента первой группы была 20%, у остальных – выше 45%. Во второй
группе средняя ФВ ЛЖ во всех случаях была выше 40%. Подавляющая часть пациентов
имела нарушение сегментарной сократимости в зоне клинико-зависимой артерии (по
данным коронарографии). Ни в одном случае не выявлено постинфарктной аневризмы
ЛЖ.
Данные о распределении
пациентов по толерантности к физической нагрузке по данным велоэргометрии, в
зависимости от групп отражены в таблице 11.
Таблица 11. Толерантность
пациентов к физической нагрузке
Нагрузка, Вт |
Количество больных, n | Проценты, % | ||
| 1 группа | 2 группа | 1 группа | 2 группа | |
| 25 | 11 | 18 | 15.9 | 20.7 |
| 50 | 17 | 26 | 24.8 | 29.9 |
| 100 | 26 | 31 | 37.8 | 35.6 |
| 125 | 13 | 11 | 18.8 | 12.6 |
| Более 125 | 2 | 1 | 2.9 | 1.2 |
| Всего | 69 | 87 | 100 | 100 |
Представленные данные
показывают, что 54 (78.5%) пациента, которым впоследствии была выполнена
изолированная ТМЛР, имели толерантность к нагрузке не более 100 Вт. Во второй
группе этот показатель составил 86.2% (75 пациентов). Таким образом, большая
часть пациентов в обеих группах имела толерантность к физической нагрузке менее
100 Вт или ВЭМ не проводилась из-за тяжести исходного состояния.
3.2 Отбор больных на
операцию ТМЛР
Одна из основных задач
любого вида лечения больных ИБС состоит в устранении стенокардии. Если этого
нельзя достичь медикаментозной терапией, если сохраняется рефрактерная к
терапии ИБС, то на первое место выходит хирургический метод лечения ишемии
миокарда.
Первичный отбор больных
ИБС, рефрактерных к медикаментозной терапии, на операцию ТМЛР осуществлялся по
данным коронарографии. Основанием для отбора больных на ТМЛР явилась
идентификация множественного поражения коронарных артерий в виде “четок” (рис.
3), диффузного поражения КА с выраженным сужением просвета, либо с полным его
закрытием, когда просвет сосуда представлен непроходимыми тяжами,
перемежающимися с ”островками” бывшего коронарного русла, заполненного
контрастным веществом через коллатерали (рис 4).
Рис. 3. Коронарограмма
больного П., 58 лет. Множественные четкообразные поражения ПМЖВ на всем ее
протяжении. Видны диффузные изменения ДВ и сосудов системы ОВ

Рис. 4. Коронарограмма
больного Б., 42 лет. Боковая проекция (LAO 900). «Островки» бывшего коронарного русла ПМЖВ
Структура поражений коронарных артерий, по данным
коронарографии, которые служили показаниями для ТМЛР, представлена на рисунке
5.
Рис 5. Структура
поражений коронарных артерий по данным коронарографии
Следует отметить, что наиболее часто (37,5%) имело место
сочетание нескольких видов поражения КА, которые не позволяли выполнить прямую
реваскуляризацию миокарда.
Для определения показаний
к ТМЛР данных одной коронарографии недостаточно. Вторым обязательным условием
отбора больных должно быть наличие жизнеспособного миокарда в зонах
предполагаемого лазерного воздействия. При планировании больных на ТМЛР
получение информации о жизнеспособности миокарда важно одновременно с
нескольких позиций:
1) Рассчитывать на
эффективность ТМЛР можно только при условии наличия жизнеспособного миокарда.
2) Определение зон
обратимой дисфункции миокарда ЛЖ позволяет наметить зону лазерного воздействия
при ТМЛР.
3) Поскольку рубцовая
ткань не подлежит реваскуляризации, обнаружение рубцовых изменений в миокарде
является противопоказанием к ТМЛР.
4) Дооперационная
топическая идентификация зон с мелкоочаговыми рубцовыми изменениями миокарда
позволяет наметить зоны лазерного воздействия. Ориентирование в топике зон
рубцового поражения миокарда позволяет предотвратить формирование лазерных
каналов в этих зонах и предотвратить расширение этих зон.
Оценку жизнеспособности
миокарда мы проводили с помощью следующих методик:
1)
добутаминовая
стресс-эхокардиография,
2)
однофотонная
эмиссионная компьютерная томография или планарная сцинтиграфия миокарда.
При первичном отборе
больных по материалам коронарографии на возможность выполнения ТМЛР было
отобрано больше больных. Однако, по данным ОФЭКТ у 67% пациентов были выявлены
обратимые дефекты перфузии, которые визуализировались только на нагрузке и
замедленное вымывание РФП в данной области. Во всех этих случаях миокард был
расценен как жизнеспособный (ишемизированный) и всем этим больным была
рекомендована ТМЛР.
У 33% пациентов были выявлены
необратимые дефекты перфузии на исходных и ранних отсроченных изображениях.
Всем этим больным было проведено дополнительное исследование с реинъекцией 201Tl, после чего у этих больных дефекты перфузии значительно
уменьшились в размерах, что послужило основанием идентифицировать эту зону как
мелкоочаговые рубцовые изменения или рубцовые изменения с жизнеспособным
ишемизированным миокардом. У 4 больных дефекты перфузии сохранялись и на
изображениях, полученных после реинъекции 201Tl. Такой
миокард был расценен как нежизнеспособный и соответствовал рубцовому поражению
или аневризме ЛЖ. Этим больным было отказано в ТМЛР.
Таким образом, исходными
показаниями к применению изолированной ТМЛР явились:
1)
выраженная
клиника стенокардии, рефрактерная к обычной антиангинальной терапии;
2)
невозможность
выполнения АКШ, либо ТЛБАП в связи с диффузным поражением коронарных артерий
(КА), поражением дистального русла или наличием мелких, нешунтабельных КА;
3)
наличие в области
планируемой операции жизнеспособного миокарда или зоны риска ишемии.
Показания к операции мы
вырабатывали на основании сопоставления возможностей метода в лечении ИБС и
сложности выбора другой стратегии лечения с учетом современных представлений и
тенденций, опыта, накопленного в процессе применения ТМЛР.
3.3 Показания к сочетанным операциям
ТМЛР
Во всех сообщениях по ТМЛР
выявлено значительное (в разных исследованиях от 71% до 90%) уменьшение
стенокардии у этого тяжелейшего контингента ранее обреченных больных. Причем,
это снижение, как свидетельствуют данные литературы, имеет тенденцию к дальнейшему
улучшению [55, 89].
В большинстве сообщений
констатируется 75%–ное улучшение стенокардии, по крайней мере, на 2
функциональных класса [55, 82, 118].
С апреля 1997 года по январь 2002 года в НЦ ССХ им. А.
Н. Бакулева выполнено 165 операций ТМЛР самостоятельно, либо совместно с методами
прямой реваскуляризации миокарда. Исходные показания к операциям указаны выше.
Как известно, первая
операция ТМЛР выполнялась в сочетании с АКШ. Как только была доказана
принципиальная возможность выполнения ТМЛР, и по мере того, как были сконструированы
соответствующие лазерные установки, позволяющие обезопасить операции, ТМЛР
стали применять в качестве изолированных процедур.
Как известно, наличие
поражений в дистальных сегментах коронарных артерий не влияет на
непосредственные результаты АКШ. Однако, в отдаленные сроки наличие дистальных
сужений и диффузного поражения русла коронарных артерий существенно увеличивает
число осложнений, количество случаев с возвратом стенокардии, заметно
укорачивает сроки эффективного функционирования шунтов и, нередко,
заканчивается фатально [94, 122, 168]. Как указывают H. Schaff и соавт.
[171] наличие нешунтабельных коронарных артерий является наиболее значимым
прогностическким признаком отдаленных осложнений и летальности после АКШ.
С другой стороны, с
учетом современных представлений о механизмах эффективности ТМЛР, все больше
авторов сходится во мнении, что несмотря на то, что у большинства больных с
конечной стадией поражения коронарных артерий развиваются коллатерали, для
эффективности ТМЛР очень важно, чтобы у больного был сохранен кровоток хотя бы
по одной из главных коронарных артерий [131].
Выполнение
интегрированных операций, предполагающих сочетание ТМЛР и АКШ, преследует 2
цели. Во-первых, эффективное функционирование микрососудистой сети и
коллатералей, индуцированных ТМЛР, возможно только при наличии магистрального
кровотока хотя бы по одной из главных коронарных артерий, чего можно достичь
только с помощью АКШ. Во-вторых, при наличии хотя бы одного шунтабельного
сосуда, очевидно, при отсутствии каких-либо противопоказаний, его целесообразно
шунтировать. J. Vincent и соавт. [191] сочетали ТМЛР с АКШ в 48% случаев, A.
Diegeler и соавт. [52] — у 42,8% пациентов. Согласно S. Burns и соавт. [39],
представивших суммарный опыт проведения ТМЛР в 21 центре Европы и Азии у 967
пациентов, частота сочетания ТМЛР с АКШ в целом на все центры составила 32%. T. Krabatsch и соавт. [110] также отдает
предпочтение шунтированию всех шунтабельных коронарных артерий, сочетая АКШ с
ТМЛР в зонах нешунтабельных коронарных артерий. Они выполнили 17 таких операций
с нулевой летальностью.
Как показали результаты
изучения факторов риска летальности по данным 132 изолированных операций ТМЛР,
выполненных с помощью СО2 лазера, у больных с хорошим коронарным кровотоком
хотя бы в зоне одной коронарной артерии или бассейне коронарной артерии с хотя
бы одним проходимым шунтом после ранее выполненной АКШ, имеется значительно
меньший риск интраоперационной и отдаленной летальности [38].
По данным ряда авторов
[28, 88, 150] периоперационная летальность на ранних этапах использования ТМЛР
составляла 10 – 20%, что было обусловлено не строгим отбором пациентов: не
учитывалась возможность прямой реваскуляризации КА, не отсеивались больные с
нестабильной стенокардией. Мы на первые 10 операций потеряли двух больных
(20%).
Учитывая все
вышесказанное, требуется строгий отбор больных на изолированную ТМЛР,
необходимо учитывать возможность шунтирования КА, пригодных для этого.
Кроме того, как показали
данные однофотонной эмиссионной компьютерной томографии миокарда с 201TL, выполненной в отдаленные сроки
после изолированной ТМЛР в зонах, не подвергшихся лазерному воздействию, и
кровоснабжаемых сосудами со значительными диффузными изменениями, со временем
перфузия миокарда ухудшается [5].
В связи с этим мы полагаем, что в случае присутствия
шунтабельных сосудов задней стенки ЛЖ (тем более, если их несколько) и
нешунтабельных сосудов передней стенки необходимо выполнять прямую
реваскуляризацию сосудов задней стенки (АКШ или МИРМ) и ТМЛР передней стенки.
Таким образом, учитывая вышеперечисленные причины,
показанием для сочетанных с методами прямой реваскуляризации (АКШ или МИРМ)
операций ТМЛР, кроме вышеизложенных, является также:
4)Наличие хотя бы одного шунтабельного коронарного
сосуда.
3.4 Методика оперативных вмешательств
Все операции выполняли под комбинированным
эндотрахеальным наркозом. В зависимости от вида операции использовались
различные варианты укладки больного на столе и доступов к сердцу:
А)При проведении изолированной ТМЛР, в положении
больного на спине с приподнятым на уровне угла лопатки валиком и поворотом
плоскости операционного стола на 300 вправо, выполнялась стандартная
передне-боковая торакотомия в V или VI межреберье слева. Длина разреза не
превышала 10-12 см. После отведения легкого с помощью влажных марлевых салфеток
перикард вскрывали кпереди, либо кзади от диафрагмального нерва в зависимости
от локализации зоны ишемии. С целью улучшения экспозиции ЛЖ и его верхушки на
рассеченные края перикарда накладывали П-образные швы-держалки. Следующим
этапом обязательно проводили ревизию пораженных КА с целью принятия
окончательного решения о целесообразности выполнения ТМЛР и зонах
реваскуляризации миокарда. Интраоперационно ни в одном случае не было внесено
изменений в первоначальный план операции.
Изолированные операции ТМЛР выполняли на работающем
сердце, без использования аппарата ИК.
Должная энергия воздействия СО2 лазера регулировалась
между 20 и 30 Дж, а оптимальная длительность импульса — от 30 до 40 мс.
Контроль величины и глубины лазерного воздействия осуществлялся предварительной
пробой на плексигласовой пластине (для СО2 лазеров).
После расположения рукоятки манипулятора над
поверхностью сердца подавали импульс, синхронизированный с ЭКГ пациента
относительно зубца R. Пенетрация всей толщи миокарда при помощи 500 Вт СО2
лазера происходила за один импульс, что подтверждалось появлением пульсирующей
струи крови из трансмиокардиального канала, а так же данными ЧП ЭхоКГ в виде
пузырьков газа в полости ЛЖ. При этом нарушений ритма не возникало, а
кровотечение из канала останавливалось самостоятельно или прижатием марлевым
тупфером или салфеткой в течение 2 минут. После окончания операции перикард
ушивали редкими швами. В плевральную полость устанавливался активный дренаж, и
грудную клетку ушивали по стандартной методике.
Особенности операции с XeCl лазером заключались в том,
что в эксимерном лазере для проведения импульса используется гибкое
фиброволокно. Это позволило выполнить перфорации не только передней и
переднебоковой стенок ЛЖ, но и МЖП, а так же задней стенки ЛЖ. В остальном
операция не отличается по технике выполнения от таковой с использованием СО2
лазера. Исключение составляет техника укладки больного. При работе с эксимерным
лазером достаточно укладки на спине с приподнятым на валике углом левой
лопатки.
Б)При выполнении операции совместно с миниинвазивной
реваскуляризацией миокарда, укладка больного на столе и доступ к сердцу
определялся вариантом МИРМ (OPCAB
либо MIDCAB), а процедуру ТМЛР выполняли после
наложения маммаро- или аортокоронарных анастомозов. При этом техника лазерной
реваскуляризации не отличалась от таковой при использовании лазера, как
единственного метода реваскуляризации миокарда.
В)При выполнении ТМЛР в сочетании с АКШ с
использованием ИК и фармакохолодовой кардиоплегии, процедуру выполняли после
согревания больного и восстановления сердечного ритма, до введения протамина. В
случае использования СО2 лазера, применяли синхронизацию лазера с ЭКГ пациента,
для чего предварительно навязывали ритм с помощью электрокардиостимулятора. При
применении XeCl лазера перфорации выполняли без синхронизации с ЭКГ. За
исключением первых операций, ни в одном случае кровотечения из перфорационных
отверстий не наблюдалось и не требовалось наложения гемостатических швов.
При всех видах операций (изолированная ТМЛР, ТМЛР в
сочетании с АКШ или МИРМ) необходимо соблюдать ряд мер для избежания
повреждения папиллярных мышц, створок митрального клапана и разрыва хорд, а
также перфорации тонкостенного правого желудочка (рис. 5).
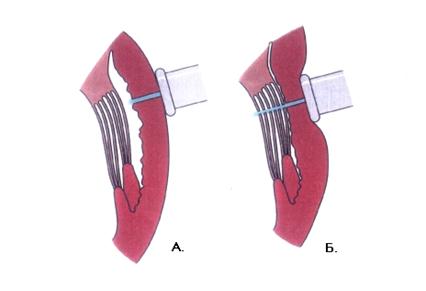
Рис.
5. Схема, поясняющая элементы техники операции по предотвращению повреждения
створок и хорд митрального клапана
А.
При наполненном ЛЖ и отсутствии внешнего давления вероятность травмы створок и
хорд МК сводится к минимуму.
Б.
Вдавление стенки левого желудочка со стороны эпикарда наконечником лазера
сближает хордально-натягивающий аппарат МК и свободную стенку ЛЖ.
Таким образом, для предотвращения разрыва створок и
хорд очень важно
—
иметь хорошее
наполнение желудочков;
—
избегать сильного
надавливания со стороны эпикарда и избыточных мощностей лазерного воздействия.
3.5 Ведение больных в раннем
послеоперационном периоде
Все больные после операции были переведены в отделение
реанимации, экстубированы в первые сутки, а затем переведены в профильное
отделение. В отделении реанимации у больных проводили мониторинг АД и ЧСС,
собирали анализы общей КФК и МВ фракции, сердечного тропонина Т (сТрТ),
контролировали газовый состав крови, каждые 3 часа регистрировали ЭКГ, в первые
сутки после операции обязательно выполняли ЭХО КГ. Больным, у которых было
выполнено аутоартериальное шунтирование, в обязательном порядке проводили
антиспастическую терапию по единому стандартному протоколу, разработанному в
нашем Центре [3] (табл 12).
Таблица 12. Стандартный протокол антиспастической терапии
Операционный этап
До начала выделения
кондуита: Дилтиазем в/в: ударная доза – 0,5 мг/кг, поддерживающаядоза –
0,15 мг/кг.
После выделения
кондуита:
внутрипросветное введение вазодилятаторов:
Папаверин – 60 мг в
растворе Рингера или гепаринизированной крови.
Укутывание артериального
трансплантата в салфетку, смоченную папаверином.
Послеоперационный этап
После завершения ИК: Дилтиазем в/в – 1 мг/кг/мин.
В реанимационном
отделении – 1-е сутки: Дилтиазем – 4 мг/ч,
2-е сутки: дилтиазем per os, 60-240 мг.
В отделении – дилтиазем
60 мг, 2 раза в день per os.
При выписке и в течение
6-12 мес: дилтиазем 120/сут или
Адалат XL – 30 мг в сутки.
Кроме того, всем больным в обязательном порядке
назначали кортикостероиды (дексазон 4 мг, каждые 8 часов, внутривенно) для
профилактики отека миокарда, возникающего после применения лазеров любого типа
[79].
Учитывая невозможность выполнения полной прямой
реваскуляризации миокарда всем больным (и после изолированных, и после
сочетанных с АКШ операций) назначали перлинганит и b–блокаторы в дооперационных дозах,
под контролем ЭКГ, АД, ЧСС.
Перед выпиской всем больным выполняли контрольную ЭКГ
и ЭХО КГ.
3.6 Обсуждение материала исследования
Как уже отмечалось выше,
одним из основных условий выполнения ТМЛР является наличие жизнеспособного
миокарда в зоне вмешательства [113, 203]. Для изучения обратимости изменений в
миокарде сегодня широко используется стресс-ЭХОКГ, перфузионная сцинтиграфия,
однофотонная эмиссионная томография (ОФЭКТ) и позитронно-эмиссионная томография
(ПЭТ). Все они основаны на идентификации различных физиологических маркеров:
ПЭТ определяет F — 18-флюородеоксиглюкозу – маркер утилизации глюкозы и
N — 13-амоний – маркер перфузии; Tl-сцинтиграфия является маркером перфузии и
целостности клеточных мембран; Стресс-ЭхоКГ оценивает резерв сократимости
миокарда [33]. В настоящее время все указанные методы используются для оценки
различных процедур реваскуляризации миокарда: АКШ, ангиопластики и
тромболизиса.
Как известно, по данным
добутаминовой стресс ЭХО КГ для признания сегмента жизнеспособным необходимо не
менее 50% живых миоцитов [9]. При меньшем количестве живых миоцитов
добутаминовая стресс ЭХО КГ менее информативна. Наоборот, изотопные методы
выявляют больший процент жизнеспособного миокарда даже в состояниях, когда
имеется менее 50 или 25% живых миоцитов. Это различие обусловлено тем, что
изотопные методы способны идентифицировать уже то небольшое количество
жизнеспособного миокарда, в котором есть перфузия и метаболизм, но которого
недостаточно для поддержания сократительной активности. Поэтому, несмотря на
то, что Tl-сцинтиграфия и ПЭТ способны идентифицировать даже небольшое количество
жизнеспособных клеток в асинергичном миокарде, добутаминовая стресс ЭХО КГ
более информативна в предсказательном плане – прогнозируемости функционального
восстановления миокарда. Более важным, однако, на наш взгляд является сочетание
этих методов, позволяющее произвести надежную оценку жизнеспособности миокарда.
В связи с этим нами для
оценки жизнеспособности миокарда в преимущественном большинстве случаев
использованы два метода: Tl-сцинтиграфия и добутаминовая стресс ЭХО КГ.
В нашем исследовании
почти все больные (97.9%) с ТМЛР в сочетании с методами прямой реваскуляризации
миокарда имели стенокардию напряжения и покоя III и IV функционального класса
(CCS), средний класс стенокардии составил 3.41, 58.6% больных имели IV ф.к.
(CCS), 69.5% больных перенесли ИМ, 27.1% из них – более двух ИМ. 58% больных
имели атеросклеротическое поражение еще одного сосудистого бассейна.
Согласно данным S. Burns
[39], который представил суммарный опыт операций ТМЛР в 21 центре Европы и Азии
у 967 пациентов, большинство пациентов (82%) перенесли в анамнезе от 1 до 7 ИМ,
70% больных в анамнезе была выполнена АКШ, 32% — ТЛБАП (из них 75% — ТЛБАП
вместе с АКШ). Средний возраст больных составил 62 года, 18% больных имели сочетанные
поражения сосудов нижних конечностей, 4% — сосудов мозга, 4% — признаки
мультифокального атеросклероза. Для сравнения, приводим сопоставление данных,
характеризующих исходное состояние больных в нашей серии и суммарные данные по
S. Burns и соавт. [13] (табл. 13).
Как свидетельствуют
представленные данные, по тяжести больных группы вполне сопоставимы. Следует
отметить меньшую частоту нестабильной стенокардии у наших пациентов, что
связано с отбором на операцию. Кроме того, в представленных данных отмечается
более тяжелый класс стенокардии у больных, вошедших в наше исследование.
Таблица 13. Исходная клиническая
характеристика больных
| НЦ ССХ им. А.Н.Бакулева |
TLR Int. Registry
|
|
Средний
|
57.2 | 62 |
| Поражение периферических артерий | 37.9% | 18% |
| Поражение сосудов головного мозга | 9.5% | 4% |
| ИМ | 69.5% | 82% |
| Нестабильная стенокардия | 6.3% | 52% |
| Функциональный класс стенокардии (CCS) | ||
| 0 — II | 2.1% | 22% |
| III | 54.7% | 37% |
| IV | 43.2% | 41% |
| ФВ ЛЖ | 52.1% | 49% |
| Артериальная гипертония | 72.1% | 59% |
| Сахарный диабет | 9.7% | 14% |
Важной особенностью
нашего исследования является то, что нами применены два типа лазерных установок
— высокоэнергетический СО2 лазер и низкоэнергетический эксимерный (XeCl) лазер,
использующие разные способы аблации миокарда. С помощью отечественного 500 Вт
СО2 лазера “Геном — 4” ТМЛР выполнена 135 больным (81.8%), а с помощью XeCl
лазера MAX 20 TMLR фирмы AutoSuture — 30 (18.2%).
Протоколы применения
обоих типов лазеров не отличаются от протоколов, описанных другими авторами
[64, 102, 179]. До настоящего времени опыт клинического использования двух
типов лазеров (Ho:YAG и СО2) доложен только A. Lansing (США) [118, 120].
Поскольку, как известно
[97], частота нарушений ритма при использовании Ho:YAG и эксимерных лазеров
значительно (в 6-18 раз) превышает аналогичный показатель при выполнении ТМЛР с
помощью СО2 лазера, первые два типа лазера редко применяются для
реваскуляризации миокарда в качестве самостоятельной процедуры. Это связано с
тем, что они производят перфорацию миокарда за несколько импульсов, не
синхронизированных с ЭКГ пациента, сопровождающихся различными дизритмиями.
В нашей серии XeCl лазер
был использован как самостоятельно, так и в сочетании с АКШ или МИРМ. Мы также
выявили более частое возникновение аритмий по сравнению с применением
углекислотного лазера. Поэтому, применение эксимерного лазера для самостоятельной
реваскуляризации достаточно спорно. По-видимому, приводимые здесь соображения,
могут быть приняты в расчет только как предварительные. Окончательные суждения
по данному вопросу требуют дальнейшего накопления материала и опыта.
Тем не менее, как
свидетельствуют представленные данные, нами в большинстве случаев использован
высокоэнергетический СО2 лазер. Высокоэнергетические СО2 лазерные установки –
единственные на сегодняшний день системы, синхронизированные с ЭКГ и
пенетрирующие миокард за один импульс в течение одного сердечного цикла.
Как свидетельствуют наши
данные, СО2 лазеры – системы, доказавшие клиническую безопасность и
эффективность. На сегодняшний день ТМЛР все чаще сочетают с АКШ. Поскольку ТМЛР
улучшает состояние миокарда только в зонах непосредственного лазерного
воздействия, либо в прилегающих зонах, очевидно, следует согласиться с мнением,
что если имеется хотя бы одна КА, подлежащая шунтированию, ее необходимо
реваскуляризировать. Так по J. G. Vincent и соавт. [191] ТМЛР сочеталось с АКШ
в 48% случаев. N. Trehan и соавт. [187] сообщил о 77 операциях ТМЛР в сочетании
с МИРМ. A. Diegeler и соавт. [52] сочетали ТМЛР с АКШ в 42,8% случаев. В то же
время, в литературе есть сообщения о ТМЛР, как о единственном методе
реваскуляризации миокарда. Согласно S. Burns и соавт. [39], представившим
суммарный опыт выполнения ТМЛР в 21-ом центре Европы и Азии у 967 пациентов,
частота сочетания ТМЛР с АКШ в целом на все центры составила 32%. В нашей серии
этот показатель составил 42%. Мы не выявили достоверной разницы в
непосредственных результатах ТМЛР в группах с изолированной процедурой и в
сочетании с АКШ. Как свидетельствует уже накопленный в Центре опыт, ТМЛР можно
с успехом сочетать с АКШ, МИРМ или ТЛБАП.
Приводим краткую выписку
из истории болезни больного К., 65 лет, которому была выполнена миниинвазивная
реваскуляризация миокарда в сочетании с ТМЛР с помощью XeCl лазера.
Больной К., 65 лет, поступил в
НЦ ССХ им. А. Н. Бакулева 20.08.98 с жалобами на типичные приступы стенокардии
при незначительной физической нагрузке (ходьба до 100 м), иногда в покое,
купирующиеся самостоятельно при прекращении физической нагрузки или приемом
нитроглицерина (1 таб. на прием, в среднем 4-6 таб./сут.). Считает себя больным
с 1982 года, когда впервые появились приступы стенокардии при физической
нагрузке. В 1987 году перенес острый инфаркт миокарда. Ухудшение состояния
последний год, когда приступы стенокардии участились, усилились.
При обследовании выявлено:
ЭКГ: Ритм синусовый. Отклонение ЭОС
влево. Данных за рубцовые изменения миокарда не получено. Признаки гипертрофии
миокарда ЛЖ.
ВЭМ: ПТ — 25 Вт. Проба положительная по
приступу стенокардии и ¯ST в V2-6 > 1.0 мм. Восстановление на 5¢.
ЭхоКГ: Уплотнение стенок аорты с
включениями кальция. КСО — 67, КДО — 117, ОФВ–52-54%. Гипокинез по заднебоковым,
переднебоковым сегментам ЛЖ и МЖП.
ЭхоКГ+добутамин: Исходно: Гипокинез по заднебоковым,
переднебоковым сегментам ЛЖ и МЖП, ОФВ–52-54%. 5-15 мкг/кг/мин: нормокинез всех
стенок, ОФВ — 59%. 20 мкг/кг/мин: появление гипокинеза на грани акинеза
задне-боковых сегментов, ОФВ — 38%.
Сцинтиграфия миокарда
с Tl — 201:
Проводилась в условиях нагрузки (25 Вт). Крупноочаговые рубцовые изменения
верхушки и МЖП, мелкоочаговое поражение передней стенки ЛЖ. Зона рубцового
поражения до 20%.
Коронарография: Ствол ЛКА – стеноз в д/3 75%. ОВ –
слабо развита, стеноз в п/3 – 75%. ВТК – диффузно изменена, стенозы в п/3 и с/3
60-70%. ПМЖВ – диффузно изменена, стеноз в п/3 75%, на границе п/3 и с/3 – до
80%, стенозы д/3 и с/3. ПКА – окклюзирована в п/3, д/3 заполняется по перетокам
из ОВ. Левая вентрикулография: Акинез 5 сегмента, ОФВ — 55%. Аортография дуги
аорты: Сонные артерии сужены, стеноз правой позвоночной артерии. Аортография
брюшного отдела аорты: брюшная аорта диффузно изменена с множественными
бляшками.
На основании обследования
больному установлен диагноз: Мультифокальный атеросклероз. ИБС: постинфарктный
кардиосклероз. Стенокардия напряжения и покоя IV ФК. С-м Такаясу. Атероматоз
брюшной аорты. Гемодинамически значимый стеноз ГБА слева. Хр. Пиелонефрит в ст.
ремиссии. Нефрогенная артериальная гипертензия.
Учитывая плохое состояние
дистального русла КА, больному была предложена операция ТМЛР.
01.09.98 больному была
выполнена операция – миниинвазивная реваскуляризация миокарда (МКШ-ПМЖВ) на
работающем сердце и ТМЛР. С помощью XeCl лазера MAX — 20 фирмы “AutoSuture” было
выполнено 17 перфорационных отверстий по переднебоковой стенке ЛЖ и в области
верхушки.
Послеоперационный период
протекал гладко. Рана зажила первичным натяжением. Больной был выписан на 8-е
сутки домой.
Через 6 месяцев после операции
самочувствие больного удовлетворительное. Приступы стенокардии не беспокоят,
нитроглицерином не пользуется. Находится в I ф.к. стенокардии.
По данным объективного
обследования:
ЭКГ: Ритм синусовый. Отклонение ЭОС
влево. Признаки гипертрофии миокарда ЛЖ. В остальном без динамики по сравнению
с дооперационными пленками.
ВЭМ: ПТ — 75 Вт. Проба положительная по
приступу стенокардии, ¯ST в I, II, avF на 1.0 мм и инверсии зубца Т в V1. Исходно: чсс — 84 в
1´, АД — 170/90 мм Hg. Максимально: чсс — 120 в 1´, АД — 170/90 мм Hg.
Стресс-ЭхоКГ: При ЭхоКГ зон гипокинеза не
зарегистрировано, ОФВ 67-69%. На высоте нагрузки (ПТ — 75 Вт) на ЭхоКГ
развивается гипокинез по нижней, заднебоковой, затем по передне-перегородочной,
передней стенкам ЛЖ со снижением ОФВ до 47%.
ЭхоКГ+добутамин: Исходно: зон гипокинеза нет, ОФВ –
63%. На малых дозах (5-15 мкг/кг/мин) – гиперкинез сегментов ЛЖ и ПЖ, ОФВ — 75%.
Стресс-доза (20 мкг/кг/мин) – развитие гипокинеза по передне- и
нижне-перегородочной стенкам ЛЖ, гипокинез выходного тракта ПЖ со снижением ОФВ
до 52%. Зона риска ишемии – нижняя перегородка ЛЖ.
Таким образом, на ТМЛР была отобрана очень тяжелая
группа больных с III-IV функциональным классом стенокардии,
с низким порогом толерантности к нагрузкам.
У всех этих больных по данным коронарографии были
выявлены изменения в дистальном русле коронарных артерий, диффузные изменения в
КА, малый калибр КА, либо сочетание этих анатомических изменений.
Вторым этапом в отборе больных было подтверждение
жизнеспособности миокарда с помощью стресс-ЭхоКГ или сцинтиграфии миокарда
(планарной сцинтиграфии или ОФЭКТ).
Больные, у которых не подтверждено наличие
жизнеспособного миокарда, отказано в операциях с ТМЛР.
В анализируемую в работе группу вошли только больные с
серьезными изменениями в анатомии КА, у которых выявлен жизнеспособный
миокарда. На сочетанные с методами прямой реваскуляризации операции отбирали
только больных с наличием хотя бы одной шунтабельной коронарной артерии.
ГЛАВА IV. КЛИНИЧЕСКИЕ РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
4.1 Непосредственные
результаты операций
В исследование включены все больные, которым с апреля 1997
года по январь 2002 года была выполнена операция ТМЛР в сочетании с другими
методами реваскуляризации миокарда. В общей сложности ТМЛР в сочетании с АКШ
выполнено 76-ти больным, в сочетании с МИРМ – 19-ти больным. Изучение
результатов этих операций (всего 95 операций) и составляет предмет настоящего
исследования.
4.1.1 Особенности
интраоперационного и ближайшего послеоперационного периода. Оценка интраоперационной
травмы миокарда
Все больные после операции изолированной ТМЛР или ТМЛР
в сочетании с прямой реваскуляризацией миокарда, были переведены в палату
реанимации в состоянии медикаментозного сна на ИВЛ. В первые часы после
операции проводился прямой контроль гемодинамики, мониторинг ЭКГ пациента,
контроль газового состава крови, кислотно-щелочного состояния и биохимических
показателей, включая ферменты-маркеры ишемии миокарда.
Учитывая воздействие лазера на миокард, особое внимание
уделяли диагностике и профилактике возможного отека и повреждения миокарда. С
этой целью каждые 3 часа регистрировали ЭКГ пациента по 6 стандартным и 6
грудным отведениям, осуществляли контроль общей КФК и МВ фракции, исследовали
уровень сердечного тропонина Т, а так же выполняли ЭХО КГ с оценкой глобальной
и региональной сократимости.
С учетом того, что лазерная перфорация миокарда во всех
случаях сопровождается его травмой, первым этапом мы оценивали выраженность
повреждения миокарда и влияние различных (не лазерных) факторов на травму
миокарда.
У всех больных первой группы во всех случаях
отмечалось повышение абсолютных показателей активности общей КФК и КФК МВ.
Средние показатели общей КФК и КФК МВ больных данной группы представлены в
таблице 14.
Таблица 14. Данные КФК и КФК МВ (ЕД/л) в ближайшие
часы после операции у больных с изолированной ТМЛР
Время после операции |
Средняя КФК | Средняя КФК МВ |
| 3 часа | 915.6±823.2 | 83.1±37.8 |
| 6 часов | 882.5±752.8 | 82.4±39.1 |
| 9 часов | 884±747.9 | 88.7±45.6 |
| 12 часов | 755.2±523.5 | 75.1±29.1 |
| 15 часов | 823.4±599.4 | 66.7±28.8 |
| 18 часов | 586.4±420.1 | 61.3±27.2 |
Как следует из таблицы,
как общая КФК, так и МВ фракция в этой группе были значительно повышенными.
Поэтому мы раздельно рассчитали эти показатели в двух группах – с инфарктом
миокарда и без него (табл. 15, 16).
Таблица 15. Данные КФК
(ЕД/л) в ближайшие часы после операции у больных после изолированной ТМЛР
| Группа | 3 часа | 6 часов | 9 часов | 12 часов | 15 часов | 18 часов |
| С ИМ | 2375±278 | 2174±193 | 2064±172 | 1402±231 | 510±122 | 430±149 |
| Без ИМ | 189.7±37.6 | 197.1±20.1 | 178.2±29.5 | 130.2±29.2 | 110.4±32.1 | 111.8±25.5 |
Таблица 16. Данные КФК
МВ (ЕД/л) в ближайшие часы после операции у больных после изолированной ТМЛР
| Группа | 3 часа | 6 часов | 9 часов | 12 часов | 15 часов | 18 часов |
| С ИМ | 342.5±104.7 | 306±104.7 | 268.5±98.3 | 245.5±110.5 | 80±49.3 | 72±38.1 |
| Без ИМ | 31.1±9.6 | 33.6±13.9 | 36.4±12.7 | 29.7±9.2 | 25.3±9.0 | 26.3±7.9 |
В данной группе (изолированная
ТМЛР) общая КФК и КФК МВ были значительно повышены у двух больных, у которых
был диагностирован инфаркт миокарда. Частота ИМ в данной группе составила 2.9%
(2/70).
Сопоставление показателей активности КФК и КФК МВ в
группе с изолированной ТМЛР с количеством перфораций миокарда (рис. 6, 7),
выявило корреляционную зависимость активности КФК МВ от числа перфораций
миокарда. Коэффициент корреляции между указанными параметрами составил 0.47,
свидетельствуя о повреждении миокарда по мере увеличения числа перфораций.
Рис. 6 Корреляционная
зависимость между показателями КФК (ЕД/л, ось Y) и количеством перфораций (ось Х) у больных с изолированной
ТМЛР. Коэффициент корреляции равен r=0.03
Рис. 7. Корреляционная зависимость между показателями
КФК МВ (ЕД/л, ось Y) и количеством
перфораций (ось Х) у больных с изолированной ТМЛР. Коэффициент корреляции r=0.47
При изучении активности тропонина Т в данной группе
выявлено, что ИМ или малое повреждение миокарда (т.е. положительный результат
тропонинового теста) диагностированы в 30% случаев (n=3). Среднее число перфораций у этих больных составило 33.3±3.1. В группе без
повреждения миокарда по тропониновому тесту, это число составило 23.8±1.2, что свидетельствует о том, что по мере увеличения числа перфораций
значительно и достоверно (p < 0.05) растет вероятность
значимого повреждения миокарда. У больных, у которых число перфораций не
превышает 30, вероятность повреждения миокарда минимальна и, наоборот, у
больных с числом перфораций более 30, повреждение миокарда клинически значимо.
Итак, в данной группе повреждение
миокарда диагностировано в 30% случаев, количество диагностированных ИМ
составило 2.9%, минимальное повреждение миокарда выявлено в 27.1% случаев.
Во второй группе, как и в
предыдущей, у всех больных показатели общей КФК и КФК МВ были повышены (табл.
17). Однако, повышение ферментов в этой группе, по сравнению с предыдущей, было
более выражено.
Таблица 17. Данные КФК и КФК МВ (ЕД/л) в ближайшие часы после
операции у больных с ТМЛР в сочетании с АКШ
| Время после операции | Средняя КФК | Средняя КФК МВ |
| 3 часа | 714±323.8 | 63.5±11.5 |
| 6 часов | 751.6±83.7 | 63.1±23.6 |
| 9 часов | 879.2±183.2 | 62.5±12.4 |
| 12 часов | 822.3±217.7 | 59.5±11.6 |
| 15 часов | 792.8±239.3 | 47.3±21.9 |
| 18 часов | 729.8±263.2 | 39.2±12.9 |
У всех больных данной группы
активность КФК МВ после оперативного вмешательства в несколько раз превышала
показатели в норме. ИМ в данной группе на основании данных КФК МВ был
диагностирован у 8-ми больных. Общая частота ИМ в группе ТМЛР в сочетании с АКШ
или МИРМ составила 8.4% (8/95).
Как следует из таблицы
17, как общая КФК, так и МВ фракция в этой группе были значительно повышенными.
Поэтому мы также, как и в предыдущей группе раздельно рассчитали эти показатели
в двух группах – с инфарктом миокарда и без него (табл. 18, 19).
Таблица 19. Данные КФК
(ЕД/л) в ближайшие часы после операции у больных после сочетанной ТМЛР.
| Группа | 3 часа | 6 часов | 9 часов | 12 часов | 15 часов | 18 часов |
| С ИМ | 342.5±104.7 | 306±104.7 | 268.5±98.3 | 245.5±110.5 | 80±49.3 | 72±38.1 |
| Без ИМ | 31.1±9.6 | 33.6±13.9 | 36.4±12.7 | 29.7±9.2 | 25.3±9.0 | 26.3±7.9 |
Таблица 20. Данные КФК
МВ (ЕД/л) в ближайшие часы после операции у больных после сочетанной ТМЛР
| Группа | 3 часа | 6 часов | 9 часов | 12 часов | 15 часов | 18 часов |
| С ИМ | 118.6±52.3 | 152±71.5 | 157.7±78.4 | 156±97.9 | 125±56.8 | 40.5±12.5 |
| Без ИМ | 49.4±12.9 | 41.8±19.8 | 39.8±16.7 | 36.6±14.0 | 32.5±13.6 | 29.5±11.8 |
При корреляционном анализе между
активностью КФК, КФК МВ и длительностью ИК (рис. 8, 9), пережатием аорты (рис.
10, 11) и количеством перфораций (рис. 12, 13) значимой корреляционной
зависимости нами не выявлено (во всех случаях коэффициент корреляции r был меньше
0.2).
Рис. 8. Корреляционная
связь между уровнем КФК (ЕД/л, ось Y) и временем искусственного кровообращения (мин, ось Х) у больных с
сочетанными операциями. Коэффициент корреляции r=0.17
Рис. 9. Корреляционная
связь между уровнем КФК МБ (ЕД/л, осьY) и временем искусственного кровообращения (мин, ось Х) у больных с
сочетанными операциями. Коэффициент корреляции r=0.17
Рис. 10. Корреляционная
связь между уровнем КФК (ЕД/л, ось Y) и временем пережатия аорты (мин, ось Х) у больных с сочетанными
операциями. Коэффициент корреляции r=0.13
Рис. 11. Корреляционная
связь между уровнем КФК МБ (ЕД/л, ось Y) и временем пережатия аорты (мин, ось Х) у больных с сочетанными
операциями. Коэффициент корреляции r=0.14
Рис. 12. Корреляционная
связь между уровнем КФК (ЕД/л, ось Y) и количеством перфораций (ось Х) у больных с сочетанными операциями.
Коэффициент корреляции r=0.15
Рис. 13. Корреляционная
связь между уровнем КФК МБ (ЕД/л, ось Y) и количеством перфораций (ось Х) у больных с сочетанными операциями.
Коэффициент корреляции r=0.17
Тем не менее, у больных, у
которых развился ИМ после интегрированных вмешательств (ТМЛР+АКШ), длительность
ИК была достоверно выше (р < 0.005), чем у больных без признаков повреждения
миокарда (t=157.2±65.1 мин. у больных с ИМ, против
118.4±37.6 мин. у больных без ИМ). При анализе тропонинового
теста повреждение миокарда выявлены в 50% случаев и он (тропониновый тест)
прямо коррелировал с временем пережатия аорты (коэффициент корреляции – 0.48).
Таким образом, инфаркт миокарда
в данной группе выявлен в 8.4%, а МПМ – в 41,6% случаев.
Сопоставление показателей общей
КФК и ее МВ фракции в обеих группах приведено на рисунках 14 и 15.
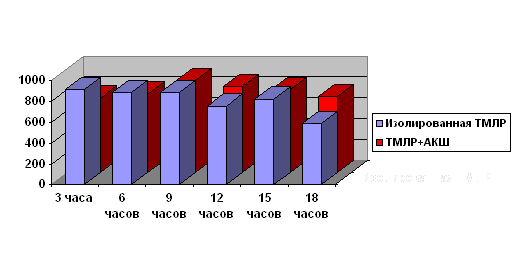
Рис 14. Данные КФК (ЕД/л, ось Y) в послеоперационном периоде (3, 6, 9, 12, 15, 18 часов
после операции, ось Х) у больных, которым выполнена операция ТМЛР в
изолированном виде, в сочетании с МИРМ или АКШ
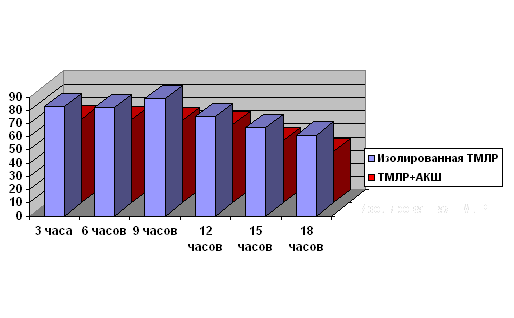
Рис 15. Данные КФК МВ
(ЕД/л, ось Y) в послеоперационном периоде (3, 6,
9, 12, 15, 18, часов после операции, ось Х) у больных, которым выполнена
операция ТМЛР в изолированном виде, в сочетании с МИРМ или АКШ
Как следует из рисунков 14, 15,
значительное увеличение общей КФК и МВ фракции КФК более выражено в группе с
изолированной ТМЛР. Однако, это увеличение недостоверно в связи с выраженной
неоднородностью группы. Один больной, у которого был диагностирован ИМ имел
уровень КФК более 4000 Ед/л и уровень КФК МВ более 300 Ед/л. В группе с
сочетанными операциями таких значение КФК и КФК МВ не было.
Очевидно, в группе с сочетанными
операциями повреждению миокарда способствуют такие факторы как манипуляции на
миокарде при выделении коронарных артерий, длительность глобальной ишемии
миокарда, вследствие пережатия аорты и феномен реперфузии. У больных 1-ой
группы повреждение миокарда в основном было связано с собственно лазерным
воздействием на миокард и частично с операционной травмой (рассечение тканей).
Анализ ЭКГ в первые часы после ТМЛР, как единственного
метода реваскуляризации миокарда, выявил один случай острого трансмурального
передне-перегородочного ИМ с распространением на боковую стенку ЛЖ. У другого
больного, которому по результатам анализа кардиоспецифичных ферментов поставили
диагноз ИМ, изменений на ЭКГ, соответствующих ИМ, выявлено не было.
Анализ послеоперационных ЭКГ остальных пациентов
первой и второй групп показал, что, несмотря на воздействие лазера на миокард,
данных за сколько-нибудь значимое повреждение миокарда или его ишемию не
выявлено. Начиная со 2-х суток (в среднем — через 2-6 дней после операции), на
ЭКГ формируется отрицательный зубец Т в стандартных и левых грудных отведениях,
соответствующих зонам лазерной реваскуляризации (А.А Хелимский, 2000). Учитывая
отсутствие клиники стенокардии, изменений со стороны сегмента ST, либо
появления Q зубца и не критическое повышение уровня КФК и КФК МВ, формирование
отрицательного Т зубца расценивали как отражение последствий перенесенного
миокардом лазерного воздействия («малое повреждение миокарда»): карбонизации,
формировании тромба в канале, его организации и формирования рубца.
Таким образом, для диагностики интраоперационного ИМ
неприемлемо использование данных только ЭКГ. Во всех наших случаях диагноз ИМ
был выставлен на основании изучения уровня активности ферментов-маркеров ишемии
миокарда. Электрокардиографически этот диагноз подтвержден только в одном
случае, что составляет 10% от всех диагностированных ИМ (1/10).
Все больные 1-ой группы были экстубированы по
показаниям, в первые сутки после операции, в среднем через 3,8±0,8 часов после вывоза из операционной.
Гемодинамика во всех случаях, включая случаи с интраоперационными ИМ,
оставалась стабильной и не требовала назначения кардиотоников. Болевой синдром
после операции умеренный, купировался стандартным назначением анальгетиков.
Суточная кровопотеря по дренажам после операции составила в среднем 50±5,4 мл. Длительность времени пребывания
в отделении реанимации в среднем составила 1,4±1,1 суток.
Терапия в ближайшем
послеоперационном периоде у больных после сочетанных операций ТМЛР+АКШ и
ТМЛР+МИРМ (группа 2) не отличалось от таковой у больных после АКШ и МИРМ, за
исключением обязательного назначения кортикостероидов, а также неполной отменой
антиангинальной терапии, получаемой больным до операции. Кроме того, больным,
которым было выполнено аутоартериальное шунтирование, в обязательном порядке
проводили антиспастическую терапию по протоколу, разработанному в нашем Центре
[3].
Больные этой группы были
экстубированы в среднем через 6,9±3,2 часов после вывоза из операционной. Гемодинамика в
большинстве случаев поддерживалась терапевтическими дозами кардиотоников (0,04±0,012 мкг/кг мин адреналина) в
течение в среднем 12,8±3,4
часов после операции. Кровопотеря после операции в среднем составила 392±79 мл. Длительность пребывания в
отделении реанимации в среднем составила 1,8±1.2 суток.
Таким образом, анализ
ближайшего послеоперационного периода показал, что процедура ТМЛР, дополняющая
АКШ, достаточно безопасна для больного и требует стандартную интенсивную
терапию в отделении реанимации. Некоторое повреждение миокарда после операций с
применением ТМЛР выявляется во всех случаях, обусловлено оно собственно
действием лазера и зависит в первую очередь от количества перфораций.
Срок пребывания больных в
стационаре не анализировался, поскольку в определенной степени он был
целенаправленно увеличен с целью более подробного обследования больных.
4.1.2 Анализ
летальности и осложнений
Госпитальная летальность среди всех больных, которым
была применена методика ТМЛР, составила 3.64% (n=6). Из числа умерших двое
больных погибло во время операции, четверо – в разные сроки после операции.
Обоим погибшим на операционном столе пациентам была выполнена изолированная
операция ТМЛР. Таким образом, интраоперационная летальность в первой группе
составила 2.9% (2/70).
В одном случае причина летального исхода заключалась в
неправильно выбранных параметрах лазера на начальных этапах применения
операции: длительность импульса и его мощность были велики и привели к
образованию ожогов в местах перфораций, что в свою очередь, привело к
нарастающей левожелудочковой недостаточности.
Во втором случае причиной летального исхода было неадекватное
анестезиологическое обеспечение операции — неадекватно корригированная во время
операции гипер- и гипотония с последующей острой сердечной недостаточностью.
Следует отметить, что оба летальных исхода имели место в период освоения
методики, когда было сделано первые 10 операций. Таким образом, если принять во
внимание так называемую «кривую обучения» («learning
curve»), которая приходится на первые 10 операций, то летальность в последующем
периоде, среди всех больных с ТМЛР, составила 2.58% (4/155) (рис. 16).
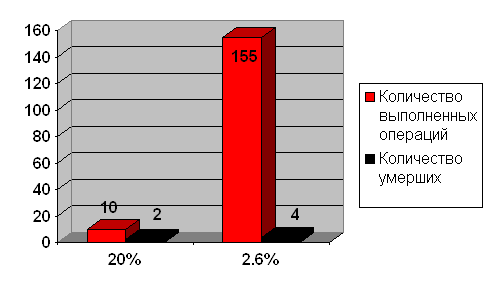
Рис. 16. Госпитальная летальность после ТМЛР на
отдельных этапах освоения и выполнения операций
Всем пациентам, погибшим в раннем (до 30 суток)
послеоперационном периоде, были выполнены операции ТМЛР в сочетании с АКШ.
Летальность во второй группе составила 4.2% (4/95).
Причина летального исхода в одном случае – сложные
нарушения ритма сердца в виде трепетания предсердий с периодическим
идиовентрикулярным ритмом. В анамнезе у этого больного полиморфная предсердная
и желудочковая экстрасистолия IV градации по Lawn, пароксизмальная узловая
re-entry тахикардия (наличие двойных путей внутриузлового проведения). Несмотря
на выполненное перед операцией устранение методом РЧА медленных путей A-V
проведения, дизритмии после операции возникли вновь и явились причиной смерти.
Другие две смерти наступили в результате полиорганной
недостаточности на фоне гипоксического отека головного мозга, возникшего, в
одном случае, в результате массивной кровопотери в постперфузионном периоде,
обусловленной синдромом диссеминированного внутрисосудистого свертывания и, во
втором случае, длительным параллельным искусственным кровообращением,
обусловленным синдромом малого выброса сердца.
Четвертый пациент погиб в результате геморрагического
шока, возникшего на 5 день после операции в результате массивного
желудочно-кишечного кровотечения. В таблице 20 приведено распределение
летальных исходов у больных с ТМЛР по группам.
Таблица 20. Летальность у больных после операций с
использованием ТМЛР
| Показатель | 1-ая группа | 2-ая группа |
| Интраоперационная | 2/70 (2.9%) | — |
| Госпитальная | — | 4/95 (4.2%) |
| Общая | 2/70 (2.9%) | 4/95 (4.2%) |
При изучении сердец больных,
умерших на операционном столе, лазерные каналы были обнаружены в области
передней, передне-боковой, боковой стенок ЛЖ и верхушки сердца. Каналы
начинались на эпикардиальной поверхности сердца и заканчивались на
эндокардиальной поверхности миокарда. В просвете лазерных каналов обнаружена
плазма крови, форменные элементы крови и фрагменты клеток миокарда. Миоциты,
расположенные по периферии канала, были либо контрактурно повреждены, либо
находились в состоянии некробиоза (рис. 17).
При изучении сердец больных,
умерших через 11-28 суток после операции, просвет лазерных каналов был
полностью закрыт элементами рыхлой соединительной ткани, форменными элементами
крови и фрагментами некротизированных миоцитов. По периферии канала наблюдалось
3-4 слоя миоцитов в состоянии некроза (рис. 18, 19).

Рис. 17. Срез миокарда.
Окраска гематоксилин-эозином (увеличение: об.х10, ок.х10). Канал заполнен
фибрином, пропитанным сегментоядерными лейкоцитами. Кардиомиоциты,
расположенные по периферии канала, вакуолизированы, местами разрушены. Сразу за
этой зоной обнаруживается выраженная лейкоцитарная инфильтрация

Рис. 18. Срез миокарда (11
дней после операции). Окраска гематоксилин-эозином (увеличение: об. х10, ок.х 10).
Канал облитерирован рыхлой соединительной тканью, внутри которой видны остатки
саркоплазмы погибших кардиомиоцитов. В клетчатке обнаруживается диффузная
инфильтрация лимфогистиоцитарными элементами, а также большое количество
активных фибробластов и макрофагов, нагруженных гемосидерином.

Рис. 19. Срез миокарда (28
дней после операции). Окраска гематоксилин-эозином (увеличение: об.х10,
ок.х10).
Канал полностью облитерирован
за счет разрастания рыхлой соединительной ткани с обилием сосудов типа
синусоидов, капилляров и мелких артерий в зонах фиброза.
Таким образом, как
свидетельствуют наши данные, независимо от типа используемого лазера, лазерные
каналы были открыты только у больных, умерших на операционном столе. Во всех 3
сердцах больных, умерших после ТМЛР в сроки от 9 до 28 дней, выполненной с
помощью СО2 и ХеСl лазера, лазерные каналы были
закрыты. Просвет каналов был выстлан рыхлой соединительной тканью. По периферии
каналов было обнаружено 3-4 слоя некротизированных миоцитов. Анализ этих данных
в динамике свидетельствует о том, что независимо от типа использованного
лазера, каналы проходимы только в течение одних (возможно, нескольких) суток
после операции. Затем они окклюзируются тромбами, которые в течение 1-4 недель
после операции замещаются фиброзным рубцом.
Во всех случаях не было
выявлено технических погрешностей выполнения операций, все анастомозы были
проходимы и имели достаточный диаметр.
В группе с изолированной ТМЛР
общий процент послеоперационных осложнений составил 12.9% (n=9).
В двух случаях, как уже указывалось выше, был выявлен ИМ в ближайшие часы после
операции. В одном случае диагноз ИМ был поставлен на основании данных анализа
кардиоспецифичных маркеров (КФК, КФК МВ, сТрТ), без каких-либо проявлений на
ЭКГ. У другого больного развился передне-перегородочный с переходом на боковую
стенку, Q-волновой ИМ, подтвержденный данными
активности ферментов-маркеров. Гемодинамически этот больной протекал без
каких-либо особенностей и, после надлежащей терапии был выписан на 21 сутки
после операции.
В одном случае, в первые часы
после операции, мы имели кровотечение из места лазерной перфорации,
потребовавшее экстренной реторакотомии. Кровотечение было остановлено путем
ушивания перфорационного отверстия. В дальнейшем этот больной протекал без
особенностей и был выписан на 14-е сутки после операции.
У одного больного
послеоперационный период осложнился развитием напряженного пневмоторакса на 2-е
сутки после операции. После установки активного плеврального дренажа, мы
добились его разрешения на 4-е сутки после операции. Больной был выписан на
14-е сутки.
Гнойно-септические осложнения
мы имели у 2-х больных. В одном случае на 7-е сутки после операции был
диагностирован левосторонний осумкованный плеврит, потребовавший ревизии и
санации плевральной полости с установкой активных плевральных дренажей и
промывной системы. Этот больной был выписан на 22-е сутки после операции. В
другом случае мы наблюдали поверхностную раневую инфекцию. После усиленной
антибактериальной терапии, рана зажила вторичным натяжением.
У трех пациентов нами была
диагностирована послеоперационная межреберная невралгия, не потребовавшая
дополнительного назначения медикаментозных средств или продления срока
госпитализации.
Таким образом, частота
осложнений после изолированной ТМЛР составила 12.9%. Характер этих осложнений
представлен в табл. 21.
Таблица 21. Осложнения после
изолированной ТМЛР
| Осложнение | Количество больных, (%) |
| ИМ | 2 (2.9%) |
| Кровотечение | 1 (1.4%) |
| Пневмотаракс | 1 (1.4%) |
| Гнойно-септические | 2 (2.9%) |
| Межреберная невралгия | 3 (4.3%) |
| Всего: | 9 (12.9%) |
Общий процент осложнений после операции ТМЛР в
сочетании с методами прямой реваскуляризации миокарда составил 21.1% (n=20).
Как описывалось выше, в восьми случаях по данным
активности ферментов-маркеров повреждения миокарда нами диагностирован ИМ. У
всех этих больных ЭКГ — картина, кроме изменений свойственных последствиям
лазерного воздействия, не имела каких-либо особенностей. Все эти больные в
дальнейшем протекали без особенностей.
В трех случаях имело место диффузное кровотечение,
потребовавшее с целью его остановки массивных переливаний компонентов крови. В
дальнейшем, после коррекции уровня гемоглобина, больные были выписаны.
Дисфункция левого желудочка сердца в первые часы после
операции, обусловленная спазмом аутоартериальных кондуитов, зафиксирована в
одном случае. После проведения антиспастической терапии нарушения
сократительной способности ЛЖ были устранены.
У одного больного после операции АКШ 4-х артерий и
ТМЛР на 3-е сутки после операции развилась нормоформа мерцательной аритмии,
которая была купирована применением кордарона и кардиоверсией. В анамнезе у
этого больного отмечались эпизоды мерцательной аритмии, а по данным
холтеровского мониторирования имела место желудочковая экстрасистолия IV а
градации по Lawn.
У двух пациентов в ближайшем послеоперационном периоде
был выявлен гидроторакс, потребовавший неоднократного пунктирования, а затем и
дренирования плевральной полости. Эти больные были выписаны на 16-21-е сутки
после операции.
В 4-х случаях имело место поверхностное нагноение
послеоперационной раны (4.2%), еще в одном случае послеоперационный период
осложнился межреберной невралгией.
Таким образом, частота осложнений после операций ТМЛР,
сочетанных с методами прямой реваскуляризации миокарда составила 21.1%.
Характер этих осложнений представлен в табл. 22.
Таблица 22. Осложнения после сочетанных операций.
| Осложнение | Количество больных, (%) |
| ИМ | 8 (8.4%) |
| Кровотечение | 3 (3.2%) |
| Дисфункция ЛЖ | 1 (1.1%) |
| Нарушения ритма | 2 (2.1%) |
| Гидроторакс | 2 (2.1%) |
| Гнойно-септические | 4 (4.2%) |
| Всего: | 20 (21.1%) |
После анализа осложнений и летальных исходов был предпринят
ряд мер для их предотвращения:
—
во время операции
обязательна электрическая стабилизация миокарда с целью предотвращения
возможных аритмий, для чего применяется в/в раствор лидокаина (из расчета 2
мг/кг);
—
при выполнении
сочетанных с АКШ операций перфорации следует выполнять перед самым окончанием
ИК, с немедленным после этого введением сульфата протамина во избежание большой
кровопотери из перфорационных отверстий;
—
при выполнении
сочетанных с МИРМ операций, перфорации лазером выполняют только при полной
уверенности в гемодинамической стабильности больного, под прикрытием кардиотоников
и контролем сократимости миокарда методом ЧП ЭХО КГ;
—
количество
перфораций при выполнении изолированных вмешательств не должно превышать 30, а
при операциях в сочетании с методами прямой реваскуляризации миокарда (МИРМ или
АКШ) – 20.
—
больные с
различными видами нарушений ритма в анамнезе представляют собой группу высокого
риска перед операцией ТМЛР. Целесообразность выполнения операций с применением
лазера таким больным представляется сомнительной.
Таким образом, ТМЛР, дополняющая методы прямой
реваскуляризации миокарда, достаточно безопасная процедура. С накоплением опыта
и соблюдением должных мер безопасности она сопровождается низким числом
осложнений и летальности.
4.2 Обсуждение непосредственных
результатов операций
Операцию ТМЛР в сочетании
с методами прямой реваскуляризации миокарда выполняли больным в следующих
случаях: 1) у больных имелась выраженная клиника стенокардии, рефрактерная к
обычной антиангинальной терапии; 2) диффузное поражение КА, поражение
дистального русла или наличием мелких КА; 3) в области предполагаемой операции
имелся жизнеспособный гибернированный миокард; 4) имелся хотя бы один
шунтабельный сосуд.
Последний пункт явился
для нас основополагающим, поскольку наличие нешунтабельных сегментов КА –
наиболее значимый прогностический признак отдаленных осложнений и случаев
смерти от заболеваний сердца. Согласно A. Lansing,
располагающему самым большим опытом операций ТМЛР в мире [120], в основе
реваскуляризации миокарда должен лежать принцип: реваскуляризации должны
подлежать все отделы сердца со сниженным миокардиальным кровотоком. Иными
словами, если имеется хотя бы одна КА подлежащая шунтированию, ее необходимо
реваскуляризировать. Для нас это и явилось основной предпосылкой к переходу к
сочетанным операциям.
По данным литературы, наиболее частой причиной смерти после
операции ТМЛР является периоперационный инфаркт миокарда, либо различные виды
дизритмий [39, 52, 174]. Диагностике ИМ во время операции уделяется большое
внимание, однако, она до сих пор остается несовершенной.
В клинической практике
наибольшее распространение получил распространение метод биохимической экспресс
— диагностики ИМ, позволяющий на основании серийных определений активности
изофермента МВ фракции креатиназы в сыворотке крови судить об острых
повреждениях миокарда.
По мнению большинства
авторов наиболее специфичным и чувствительным в диагностике ИМ является
определение активности сывороточной КФК и ее изофермента МВ, которая начала
применяться еще с 1966 года.
КФК содержится в
цитоплазме миокарда клеток в свободном состоянии и в значительно более высокой
концентрации, чем в сыворотке крови. При нарушении клеточных мембран вследствие
повреждения внутриклеточных структур фермент попадает в кровоток ведя к
нарастанию активности КФК в сыворотке крови, с одновременным резким падением ее
концентрации в пораженном участке сердечной мышцы [23].
Как известно, что
активность КФК зависит не только от скорости поступления изофермента в
кровоток, но и от периода полувыведения циркулирующего изофермента МВ, который
длится от 6 до 8 часов. Учитывая высокую скорость выведения изофермента из
кровотока, абсолютно неприемлемо определение активности его 1-2 раза в сутки.
Чувствительность ферментативного теста значительно увеличивается при регулярном
его определении в течении 16-18 часов с интервалом примерно через 3 часа.
Для правильной оценки
повышения активности изофермента МВ КФК многие авторы считают, что следует
учитывать и процент повышения МВ фракции от общей активности КФК и абсолютные
значения в ЕД/л, поскольку первое указывает на начало выведения, а второе – на
количество выведенного изофермента. Мы изучали все 3 показателя, а диагноз ИМ
выставлялся на основании общепринятых критериев, разработанных ВОЗ с учетом
последних поправок.
В 1971г ВОЗ разработал диагностические критерии
острого инфаркта миокарда:
-типичные или атипичные
боли в грудной клетке не менее 30 мин.
—
изменения на ЭКГ
(монофазный подъем ST и последующий
патологический зубец Q)
—
повышение
активности МВ фракции креатинфосфокиназы (КФК МВ) в ранние сроки и первой
фракции ЛДГ в более поздние сроки. Причем, ни один из этих критериев не может
быть достоверным при отсутствии других.
По данным A. Diegeler и соавт. [52] диагноз ИМ
выставляется, если: 1) появляются новые Q зубцы, отсутствующие на дооперационных ЭКГ (Minnesota Code for pathologic Q waves); 2) соотношение КФК и КФК МВ превышает 10% в 3-х
последующих пробах. Согласно R. Svedjeholm и соавт. [183] для диагностики
периоперационного ИМ или ИМ в ближайшем послеоперационном периоде необходима
идентификация нового Q зубца (>0,40 мм) или уменьшение зубца R (более чем на
25%) по крайней мере, в 2-х отведениях. Однако, при всей специфичности, данный
метод не очень чувствителен в случаях с интраоперационным ИМ [92], т.к.
исключает случаи ИМ без появления Q зубца. Наиболее достоверным критерием
развития ОИМ, как известно, является высокий уровень фермента КФК (>1600
ед.) и его МВ фракции [28].
Долгие годы своеобразным
“золотым стандартом” в диагностике ИМ служила МВ фракция креатиназы: порогового
значения в крови достигает через 12 ч и ее чувствительность в это время
составляет 100%. Нормализация уровня активности фермента происходит в среднем
через 72ч.
В качестве позднего
маркера используется определение активности первой фракции ЛДГ. Ее пороговое
значение фиксируется через 12ч, достигает максимума через 30-72ч и
нормализуется ЛДГ через 7-20 дней.
Наибольшую
диагностическую ценность на сегодняшний день имеет разработанный в 1991 г тест
на тропонин Т, белок тропонинового комплекса миокарда.
Несмотря на то, что
измерение массы КФК МВ превосходит измерение активности, метод все-таки
уступает по значению определения тропонина. КФК МВ – неспецифичен для миокарда,
и диагностическая ценность метода резко падает в случаях, когда КФК имеет
происхождение из скелетной мускулатуры. Это специфическая проблема у
кардиохирургических больных, у которых определение КФК МВ может увеличивать
число ложноположительных результатов. Преодолеть эту проблему позволяет
определение сердечных тропонинов. Согласно образному выражению T.Ryan «КФК МB
является «золотым стандартом » в диагностике ИМ, но не 24-х каратным» [167].
Традиционные маркеры ОИМ — КФК и КФК МВ пропускают одну треть пациентов с повреждением
миокарда, определяемым измерением сТрТ и сТрI.
Оценка содержания в
крови сердечных тропонинов T и I
сегодня стала новым «золотым стандартом» в диагностике острого ИМ и
«минимальных повреждений миокарда» (minor myocardial injury) (МПМ).
В нашей серии наблюдений в подавляющем большинстве случаев
значения КФК не превышали уровня 1000 ед., а величина МВ фракции не превышала
10% общей КФК. M. Mirhoseini и соавт. [140] на 12 операций ТМЛР в сочетании с
АКШ ни в одном случае не нашел повышения КФК МВ более чем 70 ед., хотя значения
общего КФК превышали 1000 ед., начиная с 6 часов после операции и возвращались
к норме к 3 дню после операции. Авторы также полагают, что выброс энзимов
представляет собой ответ на воздействие лазером на сердце и выпаривание
миокарда. M. Klein и соавт. [102] на 45 операций только в одном случае нашел
значительное повышение общего КФК и КФК МВ.
Р. Акчурин и соавт.
[2], проанализировавшие недавно результаты АКШ, при морфологическом
исследовании миокарда умерших больных в 40% случаев нашли мелкоочаговые
изменения, которые по мнению авторов связаны с реперфузионным повреждением
миокарда. Мы полагаем, что при сочетанных операциях (ТМЛР+АКШ) повреждение
миокарда вызвано несколькими факторами:
—
длительным ИК и пережатием аорты с сопутствующей глобальной ишемией
миокарда;
—
реперфузионным повреждением миокарда;
—
специфическим лазерным повреждением миокарда.
В нашей серии у
больных, у которых в этой группе развился ИМ, по сравнению с больными без
признаков повреждения миокарда, длительность ИК была выше, что согласуется с
данными T. Uchino и соавт.
[189], согласно которым уровень cTрT
всегда повышается после операций на сердце и достоверно выше в тех случаях,
когда ИК продолжается дольше.
Что касается частоты ИМ
и МПМ в группе с изолированной ТМЛР – основным фактором, определяющим
повреждение миокарда, является само лазерное воздействие. Как полагает ряд
авторов, выброс энзимов представляет собой ответ на лазерное воздействие и на
выпаривание миокарда (вапоризация). M. Mirhoseini и соавт. [140] на 12 операций
ТМЛР в сочетании с АКШ ни в одном случае не нашел повышения КФК МВ более чем 70
ед., хотя значения общего КФК превышали 1000 ед., начиная с 6 часов после
операции и возвращались к норме к 3 дню после операции. Авторы также полагают,
что выброс энзимов представляет собой ответ на воздействие лазером на сердце и
выпаривание миокарда. M. Klein и соавт. [102] на 45 операций только в одном
случае нашел значительное повышение общего КФК и КФК МВ.
Общая летальность среди всех больных, которым применялась
ТМЛР, составила 3.63% (n=6). В обоих случаях интраоперационных летальных
исходах непосредственной причиной смерти явилась острая левожелудочковая
недостаточность. Эта цифра не противоречит данным зарубежных авторов [28, 53,
64, 89, 191].
Что касается данных
гистологических исследований сердец больных, подвергшихся ТМЛР, то нами было
получено, что лазерные каналы были открыты только у больных, умерших на
операционном столе. У больных, погибших на 9-28 сутки после операции, лазерные
каналы закрыты. Аналогичные данные получены почти всеми авторами, за
исключением нескольких групп, которые считают, что каналы проходимы. М. Mirhoseini и его группа [61, 140] наблюдали старые каналы
через 2 и даже 4 года после операции. Аналогичные данные были представлены и K. Horvath и соавт. [87] — еще одной
группой, поддерживающей идею длительной проходимости лазерных каналов. На
основании экспериментальных исследований на овцах в сроки до 30 дней после
операции, выполненной с помощью СО2 лазера, авторы утверждают, что лазерные
каналы проходимы.
По данным P.
Fisher и соавт. [61],
сравнившими лазерные каналы после использования СО2 и Но:YAG
лазеров, каналы быстро окклюзируются тромбами. В течение нескольких недель они
замещаются фиброзным рубцом.
По данным N.
Yamamoto и соавт. [208] каналы быстро заполняются
тромбами и в течение 3-х недель инфильтрируются грануляционной тканью.
По данным Р. У. Гиниатуллина и
соавт. [11], изучивших 2 сердца в более поздние (через 11-12 месяцев) сроки
после ТМЛР, выполненной с помощью Nd:YAG
лазера, бывшие лазерные каналы были закрыты, а просвет — заполнен фиброзной
тканью.
По материалам исследований
проведенных в Челябинском государственном институте лазерной хирургии [16]
после перфорации миокарда в лазерных каналах очень быстро развивается тромбоз,
что ставит под сомнение их функционирование как сосудов. Тем более, что уже к
10-му дню после лазерного воздействия каналы приобретают вид прерывистых тяжей.
Как правило, на 20-е сутки просветы каналов полностью облитерированы. Многие
исследователи, преимущественно первооткрыватели данного метода и пионеры его
использования, сходились во мнении, что каналы остаются открытыми и проходимыми
длительное время.
В противоположность первым сообщениям
о проходимости каналов вышло много публикаций о том, что каналы все же
закрываются в различные сроки после операции. Большой материал представили T.
Krabatsch и соавт. [111, 113]. На основании патоморфологического исследования
сердец 11 больных, умерших в различные сроки после операции ТМЛР (на 1 — 20-е
сутки), было показано, что к 5 суткам после операции все каналы были закрыты
фибриновыми сгустками, эритроцитами и макрофагами. Вокруг каналов отмечалась
зона некроза толщиной 500 мкм [111]. Ко 2-3 неделе после операции отмечено
замещение свежих тромбов грануляционной тканью различной плотности [113].
Сходную гистологическую картину у умерших больных после операции ТМЛР приводят
и другие авторы [37, 49, 71]. В экспериментальных моделях на различных животных
с использованием как СО2, так и гольмиевого лазеров, в последнее время не было
обнаружено открытых и проходимых каналов [36, 62, 63, 73, 107, 145, 147]. Таким
образом, на сегодняшний день с большой долей уверенности можно сказать, что
каналы, проделанные в миокарде с помощью лазеров различных типов, закрываются в
течение ближайших 24 — 48 часов после операции. Вначале в просвете канала
формируются тромбы, состоящие из коллагеновых волокон и клеточных элементов,
впоследствии происходит репаративный фиброз и замещение тромбов грануляционной
тканью, характерной для обычного воспалительного процесса [70, 71, 113].
Другими, не менее редкими осложнениями во время операции
могут быть: различные виды аритмий, сердечная недостаточность, требующая
кардиотонической поддержки и ВАБК [29, 30, 52, 53, 174]. В нашей серии
наблюдений в число осложнений во время операции вошел один случай возникновения
желудочковой тахикардии во время использования эксимерного лазера,
потребовавший применения дефибриллятора. Кроме того, в ближайшем
послеоперационном периоде — случай возникновения сложных нарушений ритма сердца
в виде трепетания предсердий с периодическим идиовентрикулярным ритмом
повлекшие за собой смерть больного.
Еще у одного больного после операции АКШ 4-х артерий и ТМЛР
на 3-е сутки после операции развилась нормоформа мерцательной аритмии, которая
была купирована применением кордарона и кардиоверсией. В анамнезе у этого
больного отмечались эпизоды мерцательной аритмии, а по данным холтеровского
мониторирования имела место экстрасистолия IV градации по Lawn.
Для сравнения приводим
сводную таблицу периоперационных осложнений после операции ТМЛР по данным
различных авторов (табл. 23).
Общая частота осложнений
в группе сочетанных операций составила 21.1% (n=20). Приводим сопоставление осложнений в нашей группе в
сравнении со сводными данными по материалам TLR International Registry [39]
(таблица 24). Как следует из представленных данных, характер осложнений в обеих
группах одинаков, а частота их в нашем Центре вполне сопоставима со сводными
данными, приводимыми в литературе.
Таблица 24. Сравнительная
характеристика осложнений
| Осложнения |
НЦ ССХ им. А. Н. Бакулева
|
TLR int. Registry |
| Без осложнений | 78.9% | 70,6% |
| Кровотечения | 3.2% | 7,6% |
| Инфекции | 4.2% | 4,1% |
| Дисфункция ЛЖ | 1.1% | 8,2% |
| Аритмии | 2.1% | 10% |
| ИМ | 8.4% | 3,5% |
| Прочие осложнения | 1.8% | 9,7% |
Несколько большее
количество ИМ в нашей серии, чем в данных, представленных S. Burns [39], по-видимому, обусловлено другими критериями
постановки диагноза ИМ, нежели те, которыми пользовались мы. Как указывалось
выше мы опирались на значения активности прежде всего тропонина Т, а также
общей КФК и КФК МВ.
Приводим еще одну
короткую выписку из истории болезни больного Б., 64 лет, которому выполнена
сочетанная операция АКШ+ТМЛР.
Больной Б., 64 лет, поступил в
НЦ ССХ им. А. Н. Бакулева с жалобами на типичные приступы стенокардии,
возникающие при минимальной физической нагрузке и в покое, очень редко ночью.
Приступы купировались в покое или приемом нитроглицерина (1 таб. на прием, в
среднем 6-8 таб./сут.). Из анамнеза известно, что в 1986 году без
предшествующей стенокардии перенес острый инфаркт миокарда. До 1999 года жалоб
не предъявлял. В апреле 1999 года был госпитализирован после затяжного приступа
стенокардии. Несмотря на проводимую антиангинальную терапию отмечает ухудшение
состояния за последний год.
При обследовании выявлено:
ЭКГ: Ритм синусовый. Отклонение ЭОС
влево. Блокада передней ветви левой ножки пучка Гиса. Гипертрофия миокарда ЛЖ.
Выраженные ишемические изменения передних, передне-боковых и верхушечных
сегментов ЛЖ.
Холтеровское мониторирование: желудочковая экстрасистолия IV
градации по Lawn.
ЭхоКГ: Умеренная гипертрофия стенок ЛЖ без
увеличения массы миокарда, объемы камер не увеличены. Сократительная функция ЛЖ
удовлетворительная. ОФВ–57%.
Коронарография: Ствол ЛКА не изменен. ОВ – стеноз в
с/3 – 70%. ВТК – в с/3 — 70%. ПМЖВ – стенозы в д/3 и с/3 70-80%. ПКА – стеноз в
д/3 – 85%.
На основании обследования
больному установлен диагноз: Атеросклероз. ИБС: постинфарктный кардиосклероз.
Стенокардия напряжения и покоя IV ФК. Пароксизмальная форма мерцательной
аритмии.
12.08.99 больному была
выполнена операция – МКШ-ПМЖВ, АКШ ЗМЖВ ПКА, ЗБВ ПКА. Учитывая диффузный
характер поражения ПМЖВ и поражение дистального русла прямая реваскуляризация
была дополнена ТМЛР. С помощью СО2 лазера было выполнено 26 перфорационных
отверстий по переднебоковой стенке ЛЖ и в области верхушки.
Ближайший послеоперационный
период на 2-е сутки осложнился мерцанием и трепетанием предсердий, рефрактерным
к антиаритмической терапии. Синусовый ритм был восстановлен кардиоверсией. В
дальнейшем послеоперационный период протекал гладко. Рана зажила первичным
натяжением. Больной был выписан на 15 сутки домой в удовлетворительном
состоянии.
Факторами риска операции по данным литературы считаются:
возраст старше 55 лет [28], регургитация на митральном клапане, перенесенный ИМ
в бассейне ПМЖВ, хроническая застойная сердечная недостаточность [64]. Как уже
отмечалось выше, мы учитывали эти факторы при отборе больных на операцию. Это
позволило снизить риск летальных осложнений до минимума. В наших наблюдениях
интраоперационная смертность в обоих случаях применения методики в качестве
монотерапии была обусловлена острой сердечной недостаточностью вследствие
ошибок, допущенных на этапе освоения процедуры.
D. Burkhoff
и соавт. [38] попытались индентифицировать факторы, увеличивающие риск
осложнений после ТМЛР. В частности они нашли, что хороший кровоток хотя бы по
одной КА или шунту значительно снижает риск периоперационной и отдаленной
летальности в сравнении с больными с тремя «незащищенными» коронарными
артериями. Также нестабильная стенокардия до операции является прогностическим
фактором осложнений [66, 91]. Так, по данным O. Frazier [66] наличие нестабильной стенокардии в течении 2-х
недель до операции в 22.9 раз увеличивает риск летального исхода. Аналогичные
данные приводят R. Dowling и
соавт., [55], применявших Ho:Yag
лазер у 85 больных, которым была налажена внутривенная инфузия антиангинальных
препаратов из-за нестабильной стенокардии. В этой группе периоперационная
смертность составила 12%, а годичная – 22.4%.
В раннем (до 30 суток) послеоперационном периоде погибло
четверо больных. Всем им были выполнены сочетанные с АКШ операции. Таким
образом, госпитальная летальность составила 4.21%. По данным зарубежной
литературы, госпитальная летальность колеблется от 2,9% [185] до 16,6% [53],
составляя в среднем 10,7% [89, 149, 150, 191]. По данным S. Burns и соавт. [39]
средняя смертность по сводным данным на 21 центр Европы и Азии составила 9,7%.
По данным K. Horvath и соавт. [89], представившим данные мультицентрового
исследования, включившим 8 центров США, смертность составила 9%. На нашем
материале госпитальная летальность составила 4.21%. Основными причинами смерти,
по данным литературы, считаются: острый инфаркт миокарда с левожелудочковой
недостаточностью, острое желудочно-кишечное кровотечение, полиорганная
недостаточность, нарушения ритма сердца, внезапная смерть (вероятнее всего на
фоне дизритмий) [28, 41].
Тем не менее, по данным
литературы нет упоминаний о больных с имеющимися, либо имевшимися в анамнезе
нарушениями ритма. Тактика в отношении этих больных нам представляется
следующей. Учитывая опасность возникновения дизритмий во время операции, либо в
раннем послеоперационном периоде, необходимо проведение до операции электрофизиологического
исследования с возможной деструкцией аритмогенной зоны и последующей массивной
антиаритмической терапией, а также интраоперационное постоянное внутривенное
введение лидокаина.
Все выжившие больные
перенесли оперативное вмешательство достаточно легко, были экстубированы в
первые сутки и переведены в профильное отделение в среднем на 2-е сутки
послеоперационного периода. Это соответствует данным литературы, согласно
которым практически все больные переводятся в отделение на 2-е сутки после операции
[44, 179]. Срок пребывания больных в стационаре нами не анализировался,
поскольку в целях подробного обследования больных он был целенаправленно
увеличен. Таким образом, непосредственные результаты позволяют считать ТМЛР,
дополняющую АКШ или МИРМ, достаточно безопасной для больных ИБС.
Следует подчеркнуть, что
группу больных ИБС, которым была выполнена процедура ТМЛР, составляли наиболее
тяжелые больные, большинство из которых находилось в IV ф.к. стенокардии и
кроме ИБС страдали многими сопутствующими заболеваниями. Всем больным было
невозможно выполнить полную реваскуляризацию миокарда, а консервативное лечение
было неэффективно. Для таких больных, чья физическая активность резко
ограничена, несмотря на максимально возможную медикаментозную терапию,
трансмиокардиальная лазерная реваскуляризация миокарда, дополняющая операции
прямой реваскуляризации, может стать единственным методом выбора в лечении ИБС.
Приведенные данные свидетельствуют о достаточной безопасности интегрированных
вмешательств, уже начиная с ближайшего послеоперационного периода.
С накоплением опыта
летальность в группе снизилась до 2.6%. Конечно, с учетом крайней исходной
тяжести больных, подвергнутых интегрированным операциям, целый ряд осложнений
предотвратить сложно, однако, детальный анализ осложнений свидетельствует о
том, что при должном отборе больных на сочетанные операции и накоплением опыта,
большую часть из них можно предотвратить.
Кроме того, как
свидетельствует анализ данных, целый ряд осложнений связан не с процедурой ТМЛР,
а собственно с АКШ, выполненным в условиях ИК.
4.3 Обследование
больных через 3 месяца после операции.
Все выжившие после
сочетанных операций пациенты были обследованы при выписке из стационара. Кроме
того, 72 (75,8%) пациента были обследованы через 3 месяца после операции. Самочувствие, по сравнению с
дооперационным, улучшилось у всех обследованных. При выписке из стационара
функциональный класс стенокардии нами не оценивался.
После
оценки жалоб, предъявляемых больными через 3 мес. после операции, было
выявлено, что из 60 пациентов, находящихся в III и IV ФК стенокардии до операции, 44 (73,3%) больных имеют I или II ФК (рис. 20).

Рис. 20. Динамика
изменения функционального класса стенокардии у больных после сочетанных
операций ТМЛР с методами прямой реваскуляризации миокарда
Средний класс стенокардии
через 3 мес. после операции составил 2,1, что достоверно ниже дооперационного
(рис. 21).

Рис. 21. Динамика
среднего функционального класса стенокардии до и через 3 мес. после сочетанных
операций ТМЛР с методами прямой реваскуляризации миокарда
При анализе серии снятых
электрокардиограмм до операции признаки преходящих нарушений коронарного
кровообращения были зафиксированы у 42 (44,2%) из 95 пациентов. В течение
госпитального периода после ТМЛР (1 мес.) количество пациентов, у которых
удалось зарегистрировать признаки преходящих ишемических изменений на ЭКГ,
уменьшилось до 11 (11,6%). Через 3 месяца после операции при контрольном
обследовании признаки преходящих ишемических изменений при ЭКГ — диагностике
были зарегистрированы у 7 (9,2%) больных (р<0,01) (рис. 22).

Рис. 22. Динамика выявления признаков преходящих
ишемических изменений до и после операции ТМЛР в сочетании с АКШ.
Значительно
снизился прием нитратов (рис. 23).

Рис. 23. Потребность в нитроглицерине у
больных с сочетанными операциями до и через 3 месяца после вмешательства
По данным ВЭМ
толерантность к физической нагрузке достоверно улучшилась. Так, до операции
82,6% пациентов имели порог толерантности к физической нагрузке не более 100
Вт. Через 3 месяца после операции этот показатель составил 31,9%.
Динамика изменений общей ФВ ЛЖ после операций представлена
на рис. 24.

Рис. 24. Динамика изменений общей фракции выброса после
сочетанных вмешательств
При выписке из стационара после операции общая ФВ возросла
по сравнению с дооперационными данными и составила в среднем 54.2 ± 1.1%. Статистически это
изменение фракции выброса оказалось недостоверным. В связи с этим нами проведен
тщательный анализ динамики нарушения сегментарной сократимости ЛЖ после
операции и вычислен индекс нарушения сегментарной сократимости (ИНСС). Как
свидетельствуют данные, представленные в таблице 25, имеется четкая тенденция к
увеличению числа нормокинетичных сегментов и, соответственно, — снижению
количества зон с гипокинезом.
Для выявления зон
нарушения локальной сократимости миокарда ЛЖ до операции анализу подверглись
2268 сегментов. Из них 1050 (46.3%) сегмента были в гипокинезе и 1218 (53.7%)
сокращались с нормальной амплитудой, т.е. в среднем на каждого пациента
приходилось 8.3 ±
0.9 гипокинетичных и 9.7 ±
0.9 нормокинетичных сегментов; индекс нарушения сегментарной сократимости
составил в среднем 1.5 ±
0.05.
Соотношение количества
нормо- и гипокинетичных сегментов, учитывая средние их значения и показатели
ИНСС, представлены в таблице 25.
Таблица 25. Динамика
изменений сегментарной сократимости миокарда до и после операции ТМЛР
Показатели |
до операции | 1 месяц | 3 месяца |
| Нормокинез |
1218 (53.7%) 9.7 ± 0.9
|
1752 (81.1%) 14.6 ± 0.8
|
676 (63.7%) 11.5 ± 1.5
|
| Гипокинез | 1050 (46.3%) 8.3 ± 0.9 |
408 (18.9%) 3.4 ± 0.8
|
386 (36.3%) 6.5 ± 1.5
|
| ИНСС | 1.5 ± 0.05 | 1.2 ± 0.04 | 1.4 ± 0.05 |
| Всего: | 2268 | 2160 | 1062 |
Для выявления зон
нарушения локальной сократимости миокарда ЛЖ после операции анализу подверглись
2160 сегментов. Из них нормальную сократительную способность имели 1752 (81.1%)
сегментов и в гипокинезе были 408 сегментов (18.9%). Значит, в среднем на
одного обследованного пациента после операции приходилось 3.4 ± 0.8 гипокинетичных и 14.6 ± 0.8 нормокинетичных сегментов;
индекс нарушения сегментарной сократимости по сравнению с дооперационным
достоверно возрос и составил в среднем 1.2 ± 0.04.
Для того, чтобы оценить изменения перфузии в различных
сегментах миокарда оперированных больных, нами, совместно с сотрудниками отдела
ядерной диагностики (вед. науч. сотр. – к.м.н. Вахромеева) НЦ ССХ им. А.Н.
Бакулева РАМН (рук. – д.м.н. И.П. Асланиди), был специально проведен
сегментарный анализ изменения перфузии миокарда после ТМЛР в сочетании с АКШ по
данным ОФЭКТ с 201TL. Исходно были изучены результаты у
20 пациентов. У 7 (35%) были выявлены обратимые и у 9 (45%)больных частично-обратимые
дефекты перфузии. Эти больные через 3 месяца после сочетанной операции были
обследованы повторно. У 4 (20%) пациентов были выявлены необратимые дефекты
перфузии. Этим больным было отказано в ТМЛР в сочетании с АКШ.
В группе больных с обратимыми
дефектами перфузии до операции существенное улучшение перфузии по всем зонам
миокарда ЛЖ, подвергшимся реваскуляризации (ТМЛР и/или АКШ), к 3 месяцу после
операции отмечалось у всех 7 (100%) больных. Эти изменения проявлялись в
исчезновении дефектов перфузии на нагрузке (рис. 24). Причем, у 1 из этих
больных шунтирование ПМЖВ не выполнялось из-за ее диффузного поражения
(проксимальный стеноз > 50%, в средней трети — 75% и в дистальном отделе
стеноз — 90%. на грани окклюзии). В области передней, передне-боковой стенок
(верхушечные и средние сегменты) и верхушки у данного больного была выполнена
только ТМЛР.
 А
А  Б
Б
Рис. 24. Перфузионные полярные диаграммы миокарда ЛЖ
больного С., 52 лет, до (А) и после (Б) ТМЛР в сочетании с коронарным
шунтированием
До операции визуализируется обратимый дефект перфузии
в области верхушки и верхушечных и средних сегментах передней стенки и передней
межжелудочковой перегородки. Зона ишемического поражения (extent) составляет 22% от площади миокарда
ЛЖ. После операции перфузия в данной области полностью нормализовалась (зона
поражения – 0%).
У другого больного хотя и был наложен
маммаро-коронарный анастомоз к ПМЖВ, однако, при контрольной шунтографии,
несмотря на проходимость шунта, ПМЖВ, вследствие ее гипоплазии и поражения
дистального русла контрастировалась слабо. У данного больного ТМЛР также, как и
у предыдущего была выполнена по передней, передне-боковой стенкам и верхушке
ЛЖ. Учитывая тот факт, что у всех 7 больных данной группы имелось диффузное
поражение ПМЖВ, а также принимая во внимание 2 вышеописанных случая, выявленное
значительное улучшение миокардиального кровотока в зонах лазерного воздействия
и кровоснабжаемых диффузно измененной ПМЖВ, позволяет предположить наличие
реального положительного эффекта от процедуры ТМЛР.
В группе больных с
частично обратимыми дефектами перфузии (9 больных), к 3 месяцам после
операции отмечалось значительное улучшение перфузии в зонах, подвергшихся
реваскуляризации (ТМЛР и/или АКШ) у 8 (89%) больных. Эти изменения проявлялись
в исчезновении и/или уменьшении в размерах дефектов перфузии на нагрузке и в
покое. Причем, у 1-го из этих больных, у которого ПМЖВ была диффузно изменена
(в проксимальной трети — стеноз 75%, в средней трети — 75% и в дистальном отделе
— 75%), в ДВ левой КА имелся устьевой стеноз более 70% и ОВ левой КА была
гипоплазирована, отмечалось достоверное улучшение перфузии по передней,
передне-боковой, задне-боковой стенкам и верхушке ЛЖ. Именно в этой зоне и была
выполнена ТМЛР. При этом из коронарных артерий, кровоснабжающих эти отделы
миокарда ЛЖ, шунтирована была только ПМЖВ (маммаро-коронарный анастомоз был
наложен после первого проксимального стеноза).
Улучшение перфузии
миокарда у данного больного, как и у других 7 больных с диффузно измененной или
гипоплазированной ПМЖВ позволяет также, как и в предыдущей группе больных с
обратимыми дефектами перфузии, сделать вывод о положительном вкладе ТМЛР.
Улучшение перфузии в заднее-нижних отделах миокарда ЛЖ (где ТМЛР не
выполнялась) свидетельствует об адекватности коронарного шунтирования.
У одного больного данной
группы, наряду с умеренным улучшением перфузии в области верхушки ЛЖ, передней
и передне-боковой стенок, в ряде областей ЛЖ (преимущественно задняя и
задне-боковая стенка) отмечалось отсутствие как положительной, так и
отрицательной динамики изменения перфузии. Иными словами, перфузия улучшилась
только в зонах, где до операции был выявлен жизнеспособный миокард. В зонах
рубцового поражения с незначительным количеством жизнеспособного миокарда
показатели перфузии не изменились.
Кроме того, мы провели
сегментарную оценку в зависимости от исходного состояния миокарда.
При
анализе изменения перфузии в зависимости от исходного состояния миокарда оценка
показателей накопления РФП осуществлялась отдельно в «леченных», «смежных» и
«нелеченных» сегментах, но при этом внутри каждой группы все сегменты были
разделены еще и по степени нарушения перфузии [группы 0 — 3 (табл. 7)].
Таблицы 26, 27 показывают
изменение показателей накопления РФП (в %) в сегментах, сгруппированных по
степени нарушения перфузии.
Как видно из таблиц, и
рисунка 25А, в «леченных» сегментах накопление РФП достоверно увеличивалось в
сегментах с исходно умеренным и значительным снижением перфузии (группы 1 и 2).
Эти изменения были более выражены и достоверны на нагрузке и, начиная уже с 3
месяца после. В сегментах с исходно выраженным снижением перфузии (группа 3),
показатели накопления РФП хотя достоверно и увеличились, но практически ни в
одном сегменте (за редким исключением) в послеоперационных исследованиях
уровень накопления РФП не превышал 50% от максимального.
Таблица 26. Показатели накопления РФП (в %) в
«леченных» сегментах на нагрузке исходно и через 3 мес. после ТМЛР в сочетании
с АКШ
| Сроки наблюдения |
Исходное
|
|||
|
Группа 0 (>75
|
Группа 1 (51 — 74%)
|
Группа 2 (30 — 50%)
|
Группа 3 (<
|
|
Исходно |
82,4 ± 5,4 | 64,9 ± 7,0 | 42,7 ± 5,6 | 28,5 ± 1,0 |
| 3 месяца после ТМЛР | 82,8 ± 6,0 | 71,3 ± 6,9 | 58,8 ± 8,2 | 46,2 ± 11,6 |
|
Достоверность Р 1-2 |
||||
| NS | Р< 0,05 |
Р< 0,05 |
Р< 0,05 |
|
Примечание: P – показатель достоверности различия
NS – различия статистически не
достоверны
В
сегментах с исходно нормальной перфузией (группа 0) показатели накопления РФП
после операции не изменялись, оставались в пределах нормы.
 А
А  Б
Б
Рис. 25. Средние
показатели накопления РФП в «леченных», «смежных» и «нелеченных» сегментах
миокарда ЛЖ на нагрузке (А) и в покое (Б) исходно и через 3 месяца после
интегрированных вмешательств
Таблица 27. Показатели
накопления РФП (в %) в «леченных» сегментах в покое исходно и через 3 мес.
после ТМЛР в сочетании с АКШ
| Сроки наблюдения |
Исходное
|
|||
|
Группа 0 (>75
|
Группа 1 (51 — 74%)
|
Группа 2 (30 — 50%)
|
Группа 3 (<
|
|
Исходно |
81,9 ± 5,3 | 67,4 ± 6,5 | один | — |
| 3 месяца после ТМЛР | 81,7 ± 5,1 | 70,6 ± 9,1 | больной | — |
Достоверность |
||||
Р 1-2 |
NS | Р< 0,05 |
всего | — |
Примечание: P – показатель достоверности различия
NS – различия статистически не
достоверны
В покое (таблица 27) в
нормально перфузируемых сегментах (группа 0) показатели накопления РФП
несколько снижались (оставаясь при этом в пределах нормы) к году после
операции. В сегментах с исходно умеренным и значительным (эта группа включала
миокардиальные сегменты только одного больного) снижением перфузии (группа 1,
2) показатели перфузии также увеличивались к 3 месяцу после операции, однако
разница в исходном и послеоперационном накоплении РФП была не такая выраженная,
как при нагрузке.
Аналогичные изменения
выявлены и в «смежных» сегментах (рис. 25Б). Показатели накопления РФП
достоверно увеличивались на нагрузке в сегментах с исходно умеренным,
значительным и выраженным снижением перфузии к 3 месяцу после операции. В покое
достоверное увеличение показателей накопления РФП отмечалось также к 3 месяцу
после операции в сегментах с исходно значительным снижением перфузии.
Таким образом, в
сегментах с исходно умеренным и значительным снижением перфузии после
сочетанных операций в отдаленные сроки возможно улучшение и даже нормализация
перфузии как при нагрузке, так и в покое.
В «нелеченных» сегментах
достоверного увеличения показателей накопления РФП в исходно нормально
перфузируемых сегментах и в сегментах с различными типами нарушения перфузии до
операции, ни при нагрузке, ни в покое выявлено не было. В покое в исходно
нормально перфузируемых сегментах (группа 0) перфузионные показатели
незначительно снижались, оставаясь при этом в пределах нормы.
Прямая реваскуляризация
миокарда, как известно, ставит своей основной задачей восстановление кровотока
по коронарному руслу. При успешной и максимально полной реваскуляризации мы
наблюдаем как нормализацию кровотока в покое, так и возможность адекватного
прироста кровотока на фоне физической нагрузки. Нормализация или относительное
увеличение коронарного резерва является еще одним ожидаемым результатом
хирургического лечения ИБС, что в свою очередь приводит к уменьшению эпизодов
транзиторной ишемии, улучшению насосной функции ЛЖ за счет восстановления
контрактильности гибернированного и станнированного миокарда.
Таким образом, по данным
сцинтиграфии миокарда, в результате хирургического лечения ожидается выявление
уменьшения нарушения перфузии на фоне нагрузки, в покое, а также уменьшение и
минимизация разницы между показателями накопления РФП на фоне нагрузки и в
покое, т.е. уменьшение стресс-индуцированных нарушений перфузии, что косвенно
отражает полноту реваскуляризации миокарда.
При анализе показателей
перфузии у пациентов, у которых отмечалась положительная динамика после
сочетанных вмешательств (ТМЛР+АКШ), мы выявили, что в результате успешной
операции наиболее существенно изменялись показатели перфузии на фоне нагрузки.
Показатели перфузии в покое также претерпевали положительные изменения, но в
меньшей степени. Эти данные хорошо коррелируют с материалами исследований, опубликованными
G.Lutter и соавт. (2000) [124].
Как показало настоящее
исследование, адекватное улучшение перфузии наблюдается только в зонах с
исходно умеренным и значительным снижением перфузии. В то же время, в зонах с
исходно выраженным снижением перфузии достаточного ее увеличения не
наблюдалось. Это позволяет предположить, что у больных с ишемической
кардиомиопатией с резко сниженной перфузией и сократимостью миокарда
рассчитывать на улучшение перфузии после ТМЛР не следует. Эти данные хорошо
коррелируют с данными K.Allen и соавт. (1999) [31], которые
считают, что наличие у больных фракции выброса ЛЖ менее 35% вообще является
противопоказанием к ТМЛР.
Что касается уменьшения
стабильных дефектов перфузии или уменьшения дефектов перфузии в покое после
реваскуляризации, то здесь представляется уместным привести некоторые
соображения. Чаще всего данные области миокарда соответствуют зонам
постинфарктного кардиосклероза, и отсутствие эффекта реваскуляризации в них
связано с невозможностью обратного развития рубцовых изменений. Однако,
достоверное уменьшение стойких дефектов перфузии можно объяснить тем, что в
участках постинфарктного кардиосклероза присутствуют как соединительнотканные
элементы, так и жизнеспособные миоциты, которые в условиях реваскуляризации начинают
активно захватывать радионуклид. Кроме того, выраженное поражение коронарного
русла (окклюзии или проксимальные стенозы эпикардиальных КА) может приводить не
только к относительному снижению коронарного кровотока на фоне нагрузки, но и к
абсолютному снижению кровотока в покое. Поэтому, уменьшение стабильных дефектов
перфузии или полная нормализация перфузии в покое после реваскуляризации могут
быть вполне закономерными.
ЗАКЛЮЧЕНИЕ.
Несмотря на огромные успехи в
традиционных методах медикаментозного и хирургического лечения ИБС, таких как
аортокоронарное шунтирование и транслюминальная баллонная ангиопластика, все
еще остается целый ряд больных, которым эти методы применить не удается. Это,
прежде всего пациенты, у которых шунтирование коронарных артерий технически не
представляется возможным. Сюда входят диффузные атеросклеротические поражения
коронарных артерий, поражения дистального русла, либо коронарные артерии
небольших размеров, непригодные для наложения анастомозов и ангиопластики. Вот
почему огромное значение в настоящее время придается изучению альтернативных
методов реваскуляризации, и в частности, трансмиокардиальной лазерной
реваскуляризации миокарда (ТМЛР).
Первоначально процедура ТМЛР
производилась преимущественно одновременно с АКШ и использованием
искусственного кровообращения. С созданием новых высокоэнергетичных 850 и 1000
Вт лазеров появилась возможность пробивать каналы в миокарде в течение одного
сердечного сокращения, то есть выполнить данную операцию на бьющемся сердце.
Это послужило новым толчком к дальнейшему развитию метода. Число подобных
операций в мире неуклонно растет. Если к 1995 году было сделано всего 300
операций ТМЛР в 25 медицинских центрах, то к концу 1998 года с использованием
новых высокоэнергетичных СО2 лазеров выполнено около 4 тысяч подобных
вмешательств.
Как известно, первая
операция ТМЛР выполнялась в сочетании с АКШ. Как только была доказана
принципиальная возможность выполнения ТМЛР, и по мере того, как были
сконструированы соответствующие лазерные установки, позволяющие обезопасить
операции, ТМЛР стали применять в качестве изолированных процедур.
Однако, как показала
история, необходимость в интегрированных операциях не отпала. Более того, как
оказалось, в ряде случаев такая комбинация вмешательств не только желательна,
но и обязательна.
Как известно, наличие
поражений в дистальных сегментах коронарных артерий не влияет на
непосредственные результаты АКШ. Однако, в отдаленные сроки наличие дистальных
сужений и диффузного поражения русла коронарных артерий существенно увеличивает
число осложнений, количество случаев с возвратом стенокардии, заметно
укорачивает сроки эффективного функционирования шунтов и, нередко,
заканчивается фатально [122, 94, 168]. Как указывают H. Schaff и соавт.
[171] наличие нешунтабельных коронарных артерий является наиболее значительным
прогностическким признаком отдаленных осложнений и летальности после АКШ.
С другой стороны, с учетом
современных представлений о механизмах эффективности ТМЛР, все больше авторов
сходится во мнении, что несмотря на то, что у большинства больных с конечной
стадией поражения коронарных артерий развиваются коллатерали, для эффективности
ТМЛР очень важно, чтобы у больного был сохранен кровоток хотя бы по одной из
главных коронарных артерий [131].
В связи с этим вновь стала
актуальной проблема сочетанных операций. Тем не менее, до сих пор не выработаны
четкие показания к этой операции, нет единого подхода к послеоперационной
оценке эффективности данного метода. Многие моменты проведения самой операции
не указаны достаточно четко. Так, например, количество перфорационных отверстий
по данным разных авторов колеблется от 10 до 50, нет единого мнения в отношении
профилактики желудочковых аритмий, которые могут возникнуть во время операции.
Таким образом, операция ТМЛР
является достаточно новым и эффективным методом реваскуляризации миокарда,
который наряду с АКШ и ТЛБАП играет важную роль в лечении больных ИБС. Вместе с
тем как сама методика, так и трактовка результатов требуют дальнейшей
разработки.
Все это определило выбор цели
нашего исследования:
Цель исследования:
изучить непосредственные результаты операции ТМЛР в сочетании с методами прямой
реваскуляризации (МИРМ, АКШ) у больных ИБС.
Задачи исследования:
1. Провести
анализ осложнений и летальности в ближайшем послеоперационном периоде после
сочетанных операций ТМЛР и АКШ; разработать методы профилактики интра- и
послеоперационных осложнений.
2. Выработать
показания к сочетанным операциям ТМЛР+АКШ у больных ИБС.
3. Оценить
интраоперационное повреждение миокарда при воздействии лазером; определить
оптимальное количество перфораций при операциях с ТМЛР.
4. Оценить
эффективность сочетанных вмешательств (ТМЛР+АКШ) у больных ИБС с конечной
стадией поражения коронарных артерий.
С апреля 1997 года по январь 2002 года в лаборатории
трансмиокардиальной лазерной реваскуляризации (зав. лабораторией – профессор
И.И. Беришвили), клинико-диагностическом отделении (зав. отделением – профессор
Ю.И. Бузиашвили) и отделении хирургического лечения сочетанных поражений
коронарных и периферических артерий (зав. отделением – д.м.н. И.Ю. Сигаев)
Научного Центра сердечно-сосудистой хирургии им. А. Н. Бакулева РАМН (дир. –
академик РАМН Л.А. Бокерия) 165 больным ИБС выполнена операция
трансмиокардиальной лазерной реваскуляризации в изолированном виде или в
сочетании с каким-либо методом прямой реваскуляризации миокарда (ТЛБАП, АКШ,
МИРМ).
Все больные были
распределены на следующие группы:
1-ая группа —
изолированные операции ТМЛР (n=70);
2-ая группа — операции
ТМЛР в сочетании с другими методами реваскуляризации миокарда (ТЛБАП, МИРМ,
АКШ) (n=95).
СО2 лазер был использован в 135 случаях (81.8%), из
них самостоятельно ТМЛР выполнена 52 больным (31.5%), в сочетании с ТЛБАП —
одному больному (0.6%), 66 больным (40%) — в сочетании с АКШ, в сочетании с
МИРМ — 17 больным (10.3%) (схема 2). В среднем во время одной операции
изолированной ТМЛР создавалось 29.4±5.9 каналов по передней, переднебоковой, боковой стенке ЛЖ, а
так же в области верхушки. В случае же сочетания ТМЛР с методами прямой
реваскуляризации миокарда этот показатель составил 22.1±4.8 каналов.
Эксимерный (XeCl) лазер
был применен в 30 случаях (18.2%): у 10 больных (6.1%) совместно с АКШ, у двух
больных (1.2%) — вместе с МИРМ, у остальных больных (10.9%) ТМЛР использована в
качестве единственной процедуры реваскуляризации миокарда. Количество
перфораций свободной стенки ЛЖ составило в среднем 21,3±1,64, межжелудочковой перегородки –
5,8±0,82. Следует подчеркнуть, что
конструктивная особенность XeCl лазера и форма передачи импульса позволяет
осуществлять перфорацию МЖП, что является одним из достоинств указанного
лазера.
Всего было выполнено 257
анастомозов с коронарными артериями, в среднем 2.71 на больного. Левая
внутренняя грудная артерия, выделенная скелетизированно, использована в 94
(98.9%), лучевая артерия – в 47 (49.5%) случаях. В одном случае пришлось
отказаться от использования ЛВГА вследствие погрешностей при ее выделении.
Кроме того, в 124 случаях в качестве кондуита использована большая подкожная
вена.
В обеих группах большинство больных составили мужчины,
преимущественно в возрасте старше 50 лет.
Диагноз ИБС был поставлен
всем больным при поступлении в НЦ ССХ им. А.Н. Бакулева РАМН на основании
жалоб, анамнеза, клиники стенокардии напряжения и/или покоя, объективных
дополнительных методов обследования. С целью определения функционального класса
стенокардии использована классификация CCS.
Подавляющее большинство
больных обеих групп находились в III и
IV функциональном классе (100% больных 1-ой группы и 97.9% больных 2-ой
группы).
Всем больным выполнена трансмиокардиальная лазерная
реваскуляризация миокарда, как в качестве единственного метода лечения (n=70), так и в сочетании с АКШ (n=95), в том числе, выполненным по
малоинвазивной методике (n=19). ТМЛР выполняли при помощи отечественного 500 Вт
СО2 лазера «Геном — 4» (n=135)
и эксимерного XeCl лазера MAX 20 TMLR фирмы AutoSuture (n=30).
Регистрацию электрокардиограммы проводили на аппаратах
Sicard 440, 460 фирмы “Siemens” в 12 стандартных отведениях с анализом ритма
сердца, нарушений проводимости, локализации ишемических изменений миокарда.
Суточное ЭКГ-мониторирование
проводили с использованием комплекса «New Wave 4.1» фирмы «Hewlett Packard»
(США). Регистрировали два отведения — VI и V5 в течение 24 часов. При расшифровке записи ЭКГ оценивали
появление ишемических изменений на ЭКГ и/или нарушений ритма.
Эхокардиографию проводили
на аппаратах Марк — 5« (Голландия) и »Sonos — 1500, 2500, 5500« фирмы »Hewlett-Packard» (США). Для расчета региональной и глобальной
сократимости левого желудочка была использована компьютерная программа «Ultra Medic Promed». При анализе эхокардиограмм рассматривали общую
фракцию выброса левого желудочка (ОФВ), нарушение локальной сократимости,
конечно-систолический размер (КСР), конечно-диастолический размер (КДР),
конечно-систолический объем (КСО), конечно-диастолический объем (КДО), наличие
аневризмы, тромба в полости ЛЖ, а также состоятельность аортального клапана.
Велоэргометрию проводили
на велоэргометре фирмы «Siemens»
по принятой в НЦ ССХ им. А. Н. Бакулева методике непрерывной ступенчато
возрастающей дозированной физической нагрузки в течение 3 минут на каждой
ступени. Проводили запись ЭКГ и контроль АД в покое до начала исследования, на
последней минуте каждой ступени, а также сразу после прекращения нагрузки на 2,
4, 6 минутах восстановительного периода вплоть до нормализации ЭКГ.
В зависимости от
выполнения максимальной физической нагрузки толерантность оценивали как очень
низкую при 25 Вт, низкую — 50 Вт, среднюю — 100 Вт; 125Вт и выше – определяли
как высокую толерантность к физической нагрузке.
Пробу не проводили
больным с нестабильной стенокардией, в течение 3-х месяцев после перенесения
острого инфаркта миокарда или нарушения мозгового кровообращения, при грубых
остаточных явлениях после нарушения мозгового кровообращения, при
недостаточности кровообращения II Б ст., ишемии нижних конечностей III ст.
Коронарографическое
исследование проводили на ангиографических установках «Angioscope D» фирмы «Siemens» (Германия), «Integris 3000» фирмы «Philips» (Голландия) по методу М. Judkins и Sones. При анализе коронарограмм определяли тип
кровоснабжения сердца, состояние основного ствола ЛКА, степень и уровень
поражения коронарных артерий, диаметр коронарных артерий, количество пораженных
артерий, наличие коллатерального кровотока.
Вентрикулография выполнялась в правой косой проекции.
Расчет ФВ ЛЖ производили по методу В. W. Gilbert (1976).
Ультразвуковые
исследования выполняли на аппаратах “Sonos — 2500”
и “Sonos — 5500” фирмы Hewlett-Packard
(США). Анализ регионарной сократимости проводили в 18 сегментах ЛЖ.
Полуколичественную оценку кинетики стенок ЛЖ осуществляли с использованием
общепринятой 4-балльной системы, где за 1 балл принимался нормокинез, за 2 –
гипокинез, за 3 – акинез и 4 — дискинез.
Стресс-эхокардиографию
проводили после предварительной отмены антиангинальных препаратов за 24 ч до
исследования и бета-блокаторов — за 36 ч. При возникновении приступов
стенокардии за этот период больные пользовались нитратами короткого действия
(нитроглицерином, изокет-спреем).
Сресс-ЭхоКГ
с ВЭМ.
Пробу с дозированной физической нагрузкой выполняли на велоэргометре “Medtronic”
фирмы Hellige (Германия) и “Sicard”
фирмы Siemens (Германия). ВЭМ
проводили в положении сидя по стандартному протоколу, принятому в НЦССХ им.
А.Н. Бакулева. После первой ступени нагрузки или при увеличении ЧСС на 10-20
уд/мин регистрировали ЭхоКГ в положении сидя (II
этап). Сократительную функцию также оценивали при окончании пробы на пике
нагрузки или во время первой минуты восстановления в горизонтальном положении (III
этап).
Стресс-ЭхоКГ с
добутамином проводили с
внутривенной инфузией препарата в начальной дозе 5 мкг/кг/мин в течение 3 мин с
постепенным увеличением дозы до 10, 15, 20, 30 и 40 мкг/мин каждые 3 мин. В
конце каждой ступени регистрировали ЭхоКГ в 4 позициях с дальнейшим анализом на
компьютере по программе “Ultra Magic Promed”. Анализ локальной сократимости
проводили исходно (в состоянии покоя), на малых дозах добутамина при
максимальном увеличении сократимости и на высоких дозах добутамина (при
развитии ишемии).
С целью определения
жизнеспособности миокарда (наличие обратимых и необратимых дефектов перфузии)
все больные были обследованы до операции. Для определения жизнеспособности
миокарда ПСЦМ с 201Tl выполнялась в
покое, либо в сочетании с нагрузочными тестами. Использовались следующие
протоколы исследования:
1.
ПСЦМ в покое + регистрация ранних (через 3 часа) и поздних (через 24
часа) отсроченных изображений;
2.
ПСЦМ в сочетании с нагрузочными тестами + регистрация ранних (через 3
часа) отсроченных изображений и в случае необходимости поздних (через 24 часа)
отсроченных изображений.
В
качестве стресс-тестов применяли нагрузочную велоэргометрию, которую проводили
по стандартной методике с общепринятыми критериями прекращения нагрузки
(возникновение приступов стенокардии или появление признаков ишемии на ЭКГ) и
чреспищеводную электростимуляцию (ЧПЭС) левого предсердия.
ОФЭКТ миокарда
проводилась по однодневному протоколу: физическая нагрузка (велоэргометрия) —
перераспределение радиофармпрепарата (РФП) через 4 часа. Ступенчатая ВЭМ
проводилась по общепринятой методике с непрерывным контролем ЭКГ, частоты
сердечных сокращений и артериального давления. Тест выполняли до появления
одного из стандартных критериев прекращения нагрузки. 201Tl (111 МВк) вводили
внутривенно на пике нагрузки, после чего пациенты продолжали выполнять
максимальную нагрузку в течение минуты (при необходимости ступень нагрузки
снижали). Исследование проводили натощак (голод не менее 6 часов). За 24 часа
до исследования всем пациентам отменяли антиангинальную терапию (антагонисты
кальция, нитраты) и за 48 часов — медикаменты с пролонгированным антиангинальным
эффектом (бета-блокаторы).
Реконструкцию срезов
миокарда ЛЖ осуществляли по стандартной томографической программе (AutoSPECT
Plus), используя фильтр Баттерворта. Для визульного анализа использовали
томографические срезы, по короткой, длинной вертикальной и длинной
горизонтальной осям миокрада ЛЖ. Для количественного анализа томосцинтиграмм
использовали метод полярного картирования реконструированного томографического
изображения миокарда (“бычий глаз”) (программа “Autoqvant”). На полярной диаграмме, где миокард левого
желудочка разбивался на 20 сегментов, автоматически выявлялась область
(сегмент) с максимальной аккумуляцией РФП. Все остальные сегменты
нормализовывались относительно максимального.
Для верификации данных
сцинтиграфии, в Центре была разработана оригинальная схема, на которой
сопоставлялись данные коронарографии и сцинтиграфии посегментно у каждого
больного.
Исходя из
комбинированной коронаро-сцинтиграфической оценки полярных диаграмм мы
производили топическую реваскуляризацию миокарда, выработанную на основе
анализа полярных диаграмм. Каждая из зон хирургического воздействия полярных
диаграмм отмечалась на указанной схеме. Кроме того, с целью топической оценки
изменений перфузии миокарда после операции указанная схема анализировалась на
всех этапах в послеоперационном периоде.
Проводилось исследование кардиомаркеров: тропонина Т,
серийное определение активности фермента креатинфосфокиназы (КФК), его МВ —
фракции в сыворотке крови в раннем послеоперационном периоде. Причем
учитывалось как абсолютное значение ферментов в ЕД/л, так и процентное
повышение изофермента МВ от общей активности КФК. Принимался во внимание и
расчет суммарного выброса как общей КФК, так и ее изоформы. Забор крови на КФК
МВ проводился у больных после операции в динамике шестикратно с интервалом 3
часа. Пробы крови брали из вены в течение 16-24 часов. Если активность МВ КФК к
этому времени не имела тенденции к возрастанию, то забор крови продолжали до
тех пор, пока показатели не снижались до величин, близких к норме.
Активность КФК и КФК МВ
определяли спектрофотометрическим методом на биохимических анализаторах крови
«Техникон» РА — 1000» и «4 Кобас Мира плюс» фирм «Байер» и «Рош-Москва»,
соответственно.
Для определения сердечного тропонина Т (сТрТ)
использовали качественный метод регистрации с помощью тест–полоски «Троп-Т»
(фирмы «Boehringer – Mannheim»).
Тест проводили на планшетке с адсорбированными
моноклональными антителами двух видов, специфичными для cTрT. Перекрестное реагирование с тропонином Т скелетных мышц в
данном тесте составляет 0%.
Клиническая характеристика материала. В наше
исследование вошли 165 больных ИБС, которым была выполнена операция с
использованием ТМЛР. Как уже отмечалось, больные были распределены на две
группы:
1-ая группа —
изолированные операции ТМЛР (n=70);
2-ая группа — операции
ТМЛР в сочетании с другими методами реваскуляризации миокарда (ТЛБАП, МИРМ,
АКШ) (n=95).
По данным анамнеза 46 больных первой группы перенесли
инфаркт миокарда в разные сроки до операции (65.7% больных), подтвержденный клинико-инструментальными
методами исследования. В 19 случаях (27.1%) отмечалось 2 и более инфаркта в
анамнезе. Инфаркт миокарда в анамнезе у больных 2-ой группы выявлен в 66
случаях (69.5%).
Все больные для купирования приступов стенокардии
пользовались нитроглицерином. В среднем больные первой группы использовали в
сутки 10.2±5.3 табл.
нитроглицерина, больные второй группы – 9.1±7.1 табл. соответственно.
При обследовании у
большинства пациентов, отнесенных к первой группе, помимо измененных коронарных
артерий имелось атеросклеротическое поражение еще одного сосудистого бассейна.
Кроме этого из
сопутствующей патологии в обеих группах у 119 больных (72.1%) отмечена
артериальная гипертензия, у 16 больных (9.7%) – сахарный диабет различной
степени тяжести, у 59 (35.8%) – хронические заболевания почек, у 2 (1.2%) –
аневризма инфраренального отдела аорты. У 16 больных (9.7%) отмечены преходящие
нарушения мозгового кровообращения, у 2-х — в анамнезе инсульт, у 12 – явления
дисциркуляторной энцефалопатии.
Холтеровское
мониторирование проведено 158 (95.8%) больным. У 84 больных (50.9%) имелась
желудочковая экстрасистолия различных градаций по Lawn. Больным, у которых была
выявлена ЖЭ III или IV градаций в дооперационном периоде проводилось насыщение
кордароном по схеме принятой в НЦ ССХ им. А.Н. Бакулева РАМН.
Средняя фракция выброса
ЛЖ у больных, вошедших в первую группу, была 49.3±3.1% и колебалась в пределах от 20% до 61%.
Отбор больных на операцию
ТМЛР. Первичный отбор
больных ИБС, рефрактерных к медикаментозной терапии, на операцию ТМЛР
осуществлялся по данным коронарографии. Основанием для отбора больных на ТМЛР
явилась идентификация множественного поражения коронарных артерий в виде
“четок”, диффузного поражения КА с выраженным сужением просвета, либо с полным
его закрытием, когда просвет сосуда представлен непроходимыми тяжами,
перемежающимися с ”островками” бывшего коронарного русла, заполненного
контрастным веществом через коллатерали.
Следует отметить, что наиболее часто (37,5%) имело место
сочетание нескольких видов поражения КА, которые не позволяли выполнить прямую
реваскуляризацию миокарда.
Для определения показаний
к ТМЛР данных одной коронарографии недостаточно. Вторым обязательным условием
отбора больных должно быть наличие жизнеспособного миокарда в зонах
предполагаемого лазерного воздействия. При планировании больных на ТМЛР
получение информации о жизнеспособности миокарда важно одновременно с
нескольких позиций:
1) Рассчитывать на
эффективность ТМЛР можно только при условии наличия жизнеспособного миокарда.
2) Определение зон
обратимой дисфункции миокарда ЛЖ позволяет наметить зону лазерного воздействия
при ТМЛР.
3) Поскольку рубцовая
ткань не подлежит реваскуляризации, обнаружение рубцовых изменений в миокарде
является противопоказанием к ТМЛР.
4) Дооперационная
топическая идентификация зон с мелкоочаговыми рубцовыми изменениями миокарда
позволяет наметить зоны лазерного воздействия. Ориентирование в топике зон рубцового
поражения миокарда позволяет предотвратить формирование лазерных каналов в этих
зонах и предотвратить расширение этих зон.
Оценку жизнеспособности
миокарда мы проводили с помощью следующих методик:
1.
добутаминовая
стресс-эхокардиография,
2.
однофотонная
эмиссионная компьютерная томография или планарная сцинтиграфия миокарда.
При первичном отборе
больных по материалам коронарографии на возможность выполнения ТМЛР было
отобрано больше больных. Однако, по данным ОФЭКТ у 67% пациентов были выявлены
обратимые дефекты перфузии, которые визуализировались только на нагрузке и
замедленное вымывание РФП в данной области. Во всех этих случаях миокард был
расценен как жизнеспособный (ишемизированный) и всем этим больным была
рекомендована ТМЛР.
У 33% пациентов были выявлены
необратимые дефекты перфузии на исходных и ранних отсроченных изображениях.
Всем этим больным было проведено дополнительное исследование с реинъекцией 201Tl, после чего у этих больных дефекты перфузии значительно
уменьшились в размерах, что послужило основанием идентифицировать эту зону как
мелкоочаговые рубцовые изменения или рубцовые изменения с жизнеспособным
ишемизированным миокардом. У 4 больных дефекты перфузии сохранялись и на
изображениях, полученных после реинъекции 201Tl. Такой
миокард был расценен как нежизнеспособный и соответствовал рубцовому поражению
или аневризме ЛЖ. Этим больным было отказано в ТМЛР.
Таким образом, исходными
показаниями к применению изолированной ТМЛР явились:
1.
выраженная
клиника стенокардии, рефрактерная к обычной антиангинальной терапии;
2.
невозможность
выполнения АКШ, либо ТЛБАП в связи с диффузным поражением коронарных артерий
(КА), поражением дистального русла или наличием мелких, нешунтабельных КА;
3.
наличие в области
планируемой операции жизнеспособного миокарда или зоны риска ишемии.
Выполнение
интегрированных операций, предполагающих сочетание ТМЛР и АКШ, преследует 2
цели. Во-первых, эффективное функционирование микрососудистой сети и
коллатералей, индуцированных ТМЛР, возможно только при наличии магистрального
кровотока хотя бы по одной из главных коронарных артерий, чего можно достичь
только с помощью АКШ. Во-вторых, при наличии хотя бы одного шунтабельного
сосуда, очевидно, при отсутствии каких-либо противопоказаний, его целесообразно
шунтировать.
Кроме того, как показали
данные однофотонной эмиссионной компьютерной томографии миокарда с 201TL, выполненной в отдаленные сроки
после изолированной ТМЛР в зонах, не подвергшихся лазерному воздействию, и
кровоснабжаемых сосудами со значительными диффузными изменениями, со временем
перфузия миокарда ухудшается [5].
В связи с этим мы полагаем, что в случае присутствия
шунтабельных сосудов задней стенки ЛЖ (тем более, если их несколько) и
нешунтабельных сосудов передней стенки необходимо выполнять прямую реваскуляризацию
сосудов задней стенки (АКШ или МИРМ) и ТМЛР передней стенки.
Таким образом, учитывая вышеперечисленные причины,
показанием для сочетанных с методами прямой реваскуляризации (АКШ или МИРМ)
операций ТМЛР, кроме вышеизложенных, является также:
4)наличие хотя бы одного шунтабельного коронарного
сосуда.
Таким образом, на ТМЛР была отобрана очень тяжелая
группа больных с III-IV функциональным классом стенокардии,
с низким порогом толерантности к нагрузкам.
У всех этих больных по данным коронарографии были
выявлены изменения в дистальном русле коронарных артерий, диффузные изменения в
КА, малый калибр КА, либо сочетание этих анатомических изменений.
Вторым этапом в отборе больных было подтверждение
жизнеспособности миокарда с помощью стресс-ЭхоКГ или сцинтиграфии миокарда
(планарной сцинтиграфии или ОФЭКТ).
Больные, у которых не подтверждено наличие
жизнеспособного миокарда, отказано в операциях с ТМЛР.
В анализируемую в работе группу вошли только больные с
серьезными изменениями в анатомии КА, у которых выявлен жизнеспособный
миокарда. На сочетанные с методами прямой реваскуляризации операции отбирали
только больных с наличием хотя бы одной шунтабельной коронарной артерии.
Интраоперационная травма миокарда. С учетом того, что
лазерная перфорация миокарда во всех случаях сопровождается его травмой, первым
этапом мы оценивали выраженность повреждения миокарда и влияние различных (не
лазерных) факторов на травму миокарда.
У всех больных
первой группы во всех случаях отмечалось повышение абсолютных показателей
активности общей КФК и КФК МВ. Как общая КФК, так и МВ фракция в этой группе
были значительно повышенными. Поэтому мы раздельно рассчитали эти показатели в
двух группах – с инфарктом миокарда и без него.
В группе изолированной ТМЛР общая КФК и КФК МВ были
значительно повышены у двух больных, у которых был диагностирован инфаркт
миокарда. Частота ИМ в данной группе составила 2.9% (2/70).
Сопоставление показателей активности КФК и КФК МВ в
группе с изолированной ТМЛР с количеством перфораций миокарда, выявило
корреляционную зависимость активности КФК МВ от числа перфораций миокарда.
Коэффициент корреляции между указанными параметрами составил 0.47,
свидетельствуя о повреждении миокарда по мере увеличения числа перфораций.
При изучении активности тропонина Т в данной группе
выявлено, что ИМ или малое повреждение миокарда (т.е. положительный результат
тропонинового теста) диагностированы в 30% случаев (n=3). Среднее число перфораций у этих больных составило 33.3±3.1. В группе без
повреждения миокарда по тропониновому тесту, это число составило 23.8±1.2, что свидетельствует о том, что по мере увеличения числа перфораций
значительно и достоверно (p < 0.05) растет вероятность
значимого повреждения миокарда. У больных, у которых число перфораций не
превышает 30, вероятность повреждения миокарда минимальна и, наоборот, у
больных с числом перфораций более 30, повреждение миокарда клинически значимо.
Итак, в данной группе
повреждение миокарда диагностировано в 30% случаев, количество
диагностированных ИМ составило 2.9%, минимальное повреждение миокарда выявлено
в 27.1% случаев.
Во второй группе (ТМЛР+АКШ), как
и в предыдущей, у всех больных показатели общей КФК и КФК МВ были повышены.
Однако, повышение ферментов в этой группе, по сравнению с предыдущей, было
выраженным в течение большего времени.
У всех больных данной группы
активность КФК МВ после оперативного вмешательства в несколько раз превышала
показатели в норме. ИМ в данной группе на основании данных КФК МВ был
диагностирован у 8-ми больных. Общая частота ИМ в группе ТМЛР в сочетании с АКШ
или МИРМ составила 8.4% (8/95).
При корреляционном анализе между
активностью КФК, КФК МВ и длительностью ИК, пережатием аорты и количеством
перфораций значимой корреляционной зависимости нами не выявлено (во всех
случаях коэффициент корреляции r был меньше 0.2).
Тем не менее, у больных, у
которых развился ИМ после интегрированных вмешательств (ТМЛР+АКШ), длительность
ИК была достоверно выше (р < 0.005), чем у больных без признаков повреждения
миокарда (t=157.2±65.1 мин. у больных с ИМ, против
118.4±37.6 мин. у больных без ИМ). При анализе тропонинового
теста повреждение миокарда выявлены в 50% случаев и он (тропониновый тест)
прямо коррелировал с временем пережатия аорты (коэффициент корреляции – 0.48).
Очевидно, в группе с сочетанными
операциями повреждению миокарда способствуют такие факторы как манипуляции на
миокарде при выделении коронарных артерий, длительность глобальной ишемии
миокарда, вследствие пережатия аорты и феномен реперфузии. У больных 1-ой
группы повреждение миокарда в основном было связано с собственно лазерным
воздействием на миокард и частично с операционной травмой (рассечение тканей).
Для диагностики интраоперационного ИМ неприемлемо
использование данных только ЭКГ. Во всех наших случаях диагноз ИМ был выставлен
на основании изучения уровня активности ферментов-маркеров ишемии миокарда.
Электрокардиографически этот диагноз подтвержден только в одном случае, что
составляет 10% от всех диагностированных ИМ (1/10).
Анализ летальности и осложнений. Госпитальная летальность среди всех
больных, которым была применена методика ТМЛР, составила 3.64% (n=6). Из числа
умерших двое больных погибло во время операции, четверо – в разные сроки после
операции. Обоим погибшим на операционном столе пациентам была выполнена
изолированная операция ТМЛР. Таким образом, интраоперационная летальность в
первой группе составила 2.9% (2/70).
В одном случае причина летального исхода заключалась в
неправильно выбранных параметрах лазера на начальных этапах применения
операции: длительность импульса и его мощность были велики и привели к
образованию ожогов в местах перфораций, что в свою очередь, привело к
нарастающей левожелудочковой недостаточности.
Во втором случае причиной летального исхода было неадекватное
анестезиологическое обеспечение операции — неадекватно корригированная во время
операции гипер- и гипотония с последующей острой сердечной недостаточностью.
Следует отметить, что оба летальных исхода имели место в период освоения
методики, когда было сделано первые 10 операций. Таким образом, если принять во
внимание так называемую «кривую обучения» («learning
curve»), которая приходится на первые 10 операций, то летальность в последующем
периоде, среди всех больных с ТМЛР, составила 2.58% (4/155).
Всем пациентам, погибшим в раннем (до 30 суток)
послеоперационном периоде, были выполнены операции ТМЛР в сочетании с АКШ.
Летальность во второй группе составила 4.2% (4/95).
Причина летального исхода в одном случае – сложные
нарушения ритма сердца в виде трепетания предсердий с периодическим
идиовентрикулярным ритмом. В анамнезе у этого больного полиморфная предсердная
и желудочковая экстрасистолия IV градации по Lawn, пароксизмальная узловая
re-entry тахикардия (наличие двойных путей внутриузлового проведения). Несмотря
на выполненное перед операцией устранение методом РЧА медленных путей A-V
проведения, дизритмии после операции возникли вновь и явились причиной смерти.
Другие две смерти наступили в результате полиорганной
недостаточности на фоне гипоксического отека головного мозга, возникшего, в
одном случае, в результате массивной кровопотери в постперфузионном периоде,
обусловленной синдромом диссеминированного внутрисосудистого свертывания и, во
втором случае, длительным параллельным искусственным кровообращением,
обусловленным синдромом малого выброса сердца.
Четвертый пациент погиб в результате геморрагического
шока, возникшего на 5 день после операции в результате массивного
желудочно-кишечного кровотечения.
Как свидетельствуют наши данные, независимо от типа
используемого лазера, лазерные каналы были открыты только у больных, умерших на
операционном столе. Во всех 3 сердцах больных, умерших после ТМЛР в сроки от 9
до 28 дней, выполненной с помощью СО2 и ХеСl лазера, лазерные каналы были закрыты. Просвет каналов был
выстлан рыхлой соединительной тканью. По периферии каналов было обнаружено 3-4
слоя некротизированных миоцитов. Анализ этих данных в динамике свидетельствует
о том, что независимо от типа использованного лазера, каналы проходимы только в
течение одних (возможно, нескольких) суток после операции. Затем они
окклюзируются тромбами, которые в течение 1-4 недель после операции замещаются
фиброзным рубцом.
В группе с изолированной ТМЛР
общий процент послеоперационных осложнений составил 12.9% (n=9).
В двух случаях, как уже указывалось выше, был выявлен ИМ в ближайшие часы после
операции. В одном случае диагноз ИМ был поставлен на основании данных анализа
кардиоспецифичных маркеров (КФК, КФК МВ, сТрТ), без каких-либо проявлений на
ЭКГ. У другого больного развился передне-перегородочный с переходом на боковую
стенку, Q-волновой ИМ, подтвержденный данными
активности ферментов-маркеров. Гемодинамически этот больной протекал без
каких-либо особенностей и, после надлежащей терапии был выписан на 21 сутки
после операции.
В одном случае, в первые часы
после операции, мы имели кровотечение из места лазерной перфорации,
потребовавшее экстренной реторакотомии. Кровотечение было остановлено путем
ушивания перфорационного отверстия. В дальнейшем этот больной протекал без
особенностей и был выписан на 14-е сутки после операции.
У одного больного
послеоперационный период осложнился развитием напряженного пневмоторакса на 2-е
сутки после операции. После установки активного плеврального дренажа, мы
добились его разрешения на 4-е сутки после операции. Больной был выписан на
14-е сутки.
Гнойно-септические осложнения
мы имели у 2-х больных. В одном случае на 7-е сутки после операции был диагностирован
левосторонний осумкованный плеврит, потребовавший ревизии и санации плевральной
полости с установкой активных плевральных дренажей и промывной системы. Этот
больной был выписан на 22-е сутки после операции. В другом случае мы наблюдали
поверхностную раневую инфекцию. После усиленной антибактериальной терапии, рана
зажила вторичным натяжением.
У трех пациентов нами была
диагностирована послеоперационная межреберная невралгия, не потребовавшая
дополнительного назначения медикаментозных средств или продления срока
госпитализации.
Таким образом, частота осложнений после изолированной
ТМЛР составила 12.9%.
Общий процент осложнений после операции ТМЛР в
сочетании с методами прямой реваскуляризации миокарда составил 21.1% (n=20).
Как описывалось выше, в восьми случаях по данным
активности ферментов-маркеров повреждения миокарда нами диагностирован ИМ. У
всех этих больных ЭКГ — картина, кроме изменений свойственных последствиям
лазерного воздействия, не имела каких-либо особенностей. Все эти больные в дальнейшем
протекали без особенностей.
В трех случаях имело место диффузное кровотечение,
потребовавшее с целью его остановки массивных переливаний компонентов крови. В
дальнейшем, после коррекции уровня гемоглобина, больные были выписаны.
Дисфункция левого желудочка сердца в первые часы после
операции, обусловленная спазмом аутоартериальных кондуитов, зафиксирована в
одном случае. После проведения антиспастической терапии нарушения
сократительной способности ЛЖ были устранены.
У одного больного после операции АКШ 4-х артерий и
ТМЛР на 3-е сутки после операции развилась нормоформа мерцательной аритмии,
которая была купирована применением кордарона и кардиоверсией. В анамнезе у
этого больного отмечались эпизоды мерцательной аритмии, а по данным
холтеровского мониторирования имела место желудочковая экстрасистолия IV а
градации по Lawn.
У двух пациентов в ближайшем послеоперационном периоде
был выявлен гидроторакс, потребовавший неоднократного пунктирования, а затем и
дренирования плевральной полости. Эти больные были выписаны на 16-21-е сутки
после операции.
В 4-х случаях имело место поверхностное нагноение
послеоперационной раны (4.2%), еще в одном случае послеоперационный период
осложнился межреберной невралгией.
Таким образом, частота осложнений после операций ТМЛР,
сочетанных с методами прямой реваскуляризации миокарда составила 21.1%.
После анализа осложнений и летальных исходов был
предпринят ряд мер для их предотвращения:
—
во время операции
обязательна электрическая стабилизация миокарда с целью предотвращения
возможных аритмий, для чего применяется в/в раствор лидокаина (из расчета 2
мг/кг);
—
при выполнении
сочетанных с АКШ операций перфорации следует выполнять перед самым окончанием
ИК, с немедленным после этого введением сульфата протамина во избежание большой
кровопотери из перфорационных отверстий;
—
при выполнении
сочетанных с МИРМ операций, перфорации лазером выполняют только при полной
уверенности в гемодинамической стабильности больного, под прикрытием кардиотоников
и контролем сократимости миокарда методом ЧП ЭХО КГ;
—
количество
перфораций при выполнении изолированных вмешательств не должно превышать 30, а
при операциях в сочетании с методами прямой реваскуляризации миокарда (МИРМ или
АКШ) – 20.
—
больные с
различными видами нарушений ритма в анамнезе представляют собой группу высокого
риска перед операцией ТМЛР. Целесообразность выполнения операций с применением
лазера таким больным представляется сомнительной.
Таким образом, ТМЛР, дополняющая методы прямой
реваскуляризации миокарда, достаточно безопасная процедура. С накоплением опыта
и соблюдением должных мер безопасности она сопровождается низким числом
осложнений и летальности.
Следует подчеркнуть, что
группу больных ИБС, которым была выполнена процедура ТМЛР, составляли наиболее
тяжелые больные, большинство из которых находилось в IV ф.к. стенокардии и
кроме ИБС страдали многими сопутствующими заболеваниями. Всем больным было
невозможно выполнить полную реваскуляризацию миокарда, а консервативное лечение
было неэффективно. Для таких больных, чья физическая активность резко
ограничена, несмотря на максимально возможную медикаментозную терапию,
трансмиокардиальная лазерная реваскуляризация миокарда, дополняющая операции
прямой реваскуляризации, может стать единственным методом выбора в лечении ИБС.
Приведенные данные свидетельствуют о достаточной безопасности интегрированных
вмешательств, уже начиная с ближайшего послеоперационного периода.
С накоплением опыта
летальность в группе снизилась до 2.6%. Конечно, с учетом крайней исходной
тяжести больных, подвергнутых интегрированным операциям, целый ряд осложнений
предотвратить сложно, однако, детальный анализ осложнений свидетельствует о
том, что при должном отборе больных на сочетанные операции и накоплением опыта,
большую часть из них можно предотвратить.
Кроме того, как
свидетельствует анализ данных, целый ряд осложнений связан не с процедурой
ТМЛР, а собственно с АКШ, выполненным в условиях ИК.
При обследовании больных
через 3 мес. после операции нами выявлено снижение среднего ФК стенокардии (с 3,8
до 2,1), значительное снижение количества принимаемых нитропрепаратов. По
данным ВЭМ достоверно улучшилась толерантность к физической нагрузке, возросла
общая фракция выброса левого желудочка. Изучение перфузии миокарда показало,
что в большинстве случаев имеется ее улучшение, причем существенный прирост
перфузии выявляется на фоне нагрузки. Достоверное улучшение перфузии отмечается
в «леченных» и «смежных» сегментах с исходно умеренным и значительным снижением
перфузии, начиная с 3-го мес. после операции.
Таким образом, применение
интегрированных операций повышает полноту реваскуляризации миокарда, очевидно,
улучшает возможность коллатерализации в зонах лазерного воздействия и
укорачивает сроки выздоровления больных. Улучшение качества жизни этих больных
и повышение толерантности к физическим нагрузкам, очевидно, следует объяснить
улучшением перфузии при нагрузке, приводящей к повышению миокардиального и
коронарного резерва.
ВЫВОДЫ
5.
Трансмиокардиальная
лазерная реваскуляризация, дополняющая методы прямой реваскуляризации миокарда
(интегрированные вмешательства) – достаточно безопасная и эффективная
процедура. С накоплением опыта она сопровождается низким числом осложнений и
летальности.
6.
После
интегрированных вмешательств в большинстве случаев перфузия миокарда левого
желудочка сердца улучшается, причем более существенное улучшение показателей
перфузии выявляется на фоне нагрузки. Достоверное улучшение перфузии отмечается
начиная с 3-го месяца после операции.
7.
Интегрированные
вмешательства обуславливают значительное снижение функционального класса
стенокардии и улучшают качество жизни больных.
8.
Показаниям к
сочетанным операциям трансмиокардиальной лазерной реваскуляризации с методами
прямой реваскуляризации миокарда у больных ИБС являются: 1) выраженная клиника
стенокардии, рефрактерная к максимальной антиангинальной терапии; 2)
невозможность выполнения АКШ в связи с диффузным поражением коронарных артерий,
поражением дистального русла или наличием мелких, нешунтабельных коронарных
артерий; 3) наличие в области операции жизнеспособного миокарда; 4) наличие
хотя бы одной шунтабельной коронарной артерии.
9.
С целью улучшения
результатов ТМЛР и предотвращения осложнений, на операцию следует брать больных
в стабильном состоянии, у которых обязательно подтверждена жизнеспособность
миокарда в зонах предполагаемого лазерного воздействия.
10.Травма миокарда всегда более выражена после операций в
условиях искусственного кровообращения. При сочетанных с методами прямой
реваскуляризации операциях трансмиокардиальной лазерной реваскуляризации,
следует выполнять не более 20 перфораций миокарда.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1.
Отбор больных на
сочетанные с трансмиокардиальной лазерной реваскуляризацией операции должен
предусматривать наличие клиники стенокардии, оценку анатомии коронарных
артерий, подтверждение жизнеспособности миокарда.
2.
При наличии хотя
бы одного шунтабельного коронарного сосуда необходимо выполнять его прямую
реваскуляризацию.
3.
Больных с
обширными рубцовыми изменениями, фракцией выброса левого желудочка сердца менее
35%, нестабильной стенокардией, серьезными аритмиями не следует планировать на
операцию ТМЛР.
4.
Травма, наносимая
миокарду в процессе выполнения процедуры трансмиокардиальной лазерной
реваскуляризации, должна быть достаточной для индуцирования ангиогенеза и
минимальной для утраты функции миокарда.
5.
Количество
перфораций при изолированной трансмиокардиальной лазерной реваскуляризации не
должно превышать 30-ти (из расчета 1 перфорация на см2 зоны лазерного
воздействия на левый желудочек сердца), а при операциях в сочетании с методами
прямой реваскуляризации – 20-ти.
6.
Оценку травмы
миокарда, диагностику интраоперационного инфаркта миокарда целесообразно
проводить с помощью анализа сердечного тропонина Т в крови.
7.
Для
предотвращения травмы хордального аппарата, клапанных структур очень важно в
процессе выполнения процедуры иметь хорошее наполнение желудочков сердца,
избегать сильного надавливания со стороны эпикарда и избыточных мощностей
лазерного воздействия.
8.
Интраоперационно,
с целью электрической стабилизации миокарда, следует применять лидокаин (2
мг/кг). После операции с целью предупреждения отека миокарда назначать
преднизолон 30 мг.
СПИСОК ЛИТЕРАТУРЫ
1.
Автандилов Г.Г.
Введение в количественную патологическую морфологию. – М., Медицина, 1980, — с.
210-212.
2.
Акчурин Р.С.
Марголина А.А., Подлеских Ю.С. и др. Развитие методов интраоперационной защиты
миокарда. Путь к совершенству или дорога в никуда. Грудная и
сердечно-сосудистая хирургия, 2001, 3: 27-30.
3.
Бокерия Л. А.,
Беришвили И. И., Сигаев И.Ю. Реваскуляризация миокарда: меняющиеся подходы и
пути развития // Грудная и сердечно-сосудистая хирургия. — 1999. — №. 6. — С.
102-112.
4.
Бокерия Л.А.,
Беришвили И.И., Бузиашвили Ю.И., Сигаев И.Ю. Трансмиокардиальная лазерная
реваскуляризация. – Москва. – 2001.
5.
Бокерия Л.А.,
Асланиди И.П., Вахромеева М.Н., Беришвили И.И., Бузиашвили Ю.И., Сигаев И.Ю.,
Рюмина Е.Н., Синьковская Е.С., Сакран А.М. Однофотонная эмиссионная
компьютерная томография миокарда с 201TL в
оценке результатов изолированной трансмиокардиальной лазерной
реваскуляризации.// Анналы хирургии. – 2002. — №3.
6.
Бредикис Ю.,
Думчюс А., Обеленюс В. и др. Техника и первые наблюдения реваскуляризации
миокарда лазерным излучением в клинике // Актуальные проблемы
сердечно-сосудистой хирургии: Тез. докл. V Всесоюз. конф. сердеч.-сосудистых
хирургов. Вильнюс, 1-3 окт. 1986 г. — М. — 1986. — С. 65-66.
7.
Бредикис Ю.,
Обеленюс В. Применение лазеров в кардиохирургии // Электронная пром-сть. —
1984. — Вып. 10. — С.49-51.
8.
Бредикис Ю., Обеленюс В., Амбарцумян Р. Лазерная хирургия проводящих
путей сердца // Кардиология. — 1985. — Т.25, № 5. — С. 98.
9.
Бузиашвили И. Ю.,
Асымбекова Э. У., Мацкеплишвили С. Т. Диагностика обратимой дисфункции миокарда
у больных ишемической болезнью сердца по данным стресс-эхокардиографии. Грудная
и сердечно-сосудистая хирургия, 1999; 6: 68-80.
10.
Бураковский В.И.
Первые шаги. Записки кардиохирурга // Знание. – 1988. – М. – С. 34.
11.
Гиниатуллин Р.У.,
Козель А.И., Евдокимов С.В., Астахова Л.В. Клинико-морфологические результаты
лазерной реваскуляризации миокарда при ишемической болезни сердца. Арх. патол.,
1999, 3: 19-22.
12.
Елисеенко В.И.,
Здрадовский С.Р., Брехов Е.И., Скобелкин О.К. Морфологическая основа
миокардиальной реваскуляризации с помощью лазера // Бюлл. Экспер. Биол. Мед. –
1984. – Том. 98, №12. — С. 737-739.
13.
Ишенин Ю.М.
Актуальные вопросы хирургического лечения ишемии органов и тканей.// В сб. I
Международой конференции по хирургии ишемии органов и тканей. — Тезисы.
Нижнекамск, 1998, сс. 8-10.
14.
Ишенин Ю.М. Роль
ангиопластических реакций в реваскуляризации при ишемии органов и тканей. //
Сингральная хирургия, 2000, С.2-3: передовая статья.
15.
Кнышев Г.В.,
Фуркало С.Н. и др. Возможности прогностической оценки состояния аортокоронарных
трансплантатов и динамики изменений коронарного русла у больных ишемической
болезнью сердца после аортокоронарного шунтирования // Груд. и
сердечно-сосудист. хирургия. –1994. — №2. – С. 27-30.
16.
Козель А.И.
Применение высокоинтенсивного лазерного излучения в кардио- и нейрохирургии. //
Лазер. Мед. – 1998. – Том. 2, вып. 1. – С. 34-36.
17.
Козлов В.И.
Современные направления в лазерной медицине // Лазер. Мед. – 1997. – Том. 1,
вып. 1. – С. 6-12.
18.
Колесов В.И.
Хирургия венечных артерий сердца // Л. – Мед. – 1977. – С. 359.
19.
Кононов А.Я.,
Зайцев В.Т. Способ лечения ишемической болезни сердца. А.С. № 4702502/14 //
Открытия и изобретения. — №30. – 1992.
20.
Корепанов В.В.,
Амбарцумян В.Р., Елисеенко В.И., Здрадовский С.Р. Лазерная трансмиокардиальная
реваскуляризация миокарда при ишемической болезни сердца // Вестн. Хирургии им.
И.И.Грекова. – 1997. – Том. 156, №5. – С. 76-78.
21.
Облавацкая О. Г.
Клиническое значение перфузионной сцинтиграфии миокарда с 201TL у больных ишемической болезнью
сердца. Автореф. Дис. канд. мед. наук. М., 1985.
22.
Прохоров А.М.,
Наседкин А.М., Щербаков И.А. и др. Экспериментально-клиническое исследование
двухмикронного гольмиевого лазера // Докл. Акад. Наук. – 1993. – Том. 300, №4.
– С. 511-513.
23.
Сапрыгин Д.Б.
Ферментная диагностика и оценка повреждения миокарда у больных, оперированных
на открытом сердце. Дисс. докт. наук, 1986.
24.
Скобелкин О.,
Бредикис Ю., Брехов Е. и др. Реваскуляризация миокарда лазерным излучением //
Хирургия — 1984. — № 10. — С.99-102.
25.
Скобелкин О.К.,
Бредикис Ю.Ю., Брехов В.И. и др. Улучшение кровоснабжения кислорода импульсным
лазером // Лазерная техника и оптоэлектроника. Электронная техника. — Сер 11. —
1984. — № 4. — С. 39-42.
26.
Хелимский А.А.
Непосредственные и среднеотдаленные результаты трансмиокардиальной лазерной
реваскуляризации у больных ИБС. Дис. канд. мед. наук. – Москва, 1999.
27.
Филоненко Н. И.
Клинико-функциональная оценка коронарного и гемодинамического резерва у больных
с окклюзирующими заболеваниями аорты и магистральных артерий в предоперационном
периоде. Дис. канд. Пермь, 1991, с. 38.
28.
Agarwal
R., Ajit M., Kurian V. M., Rajan S., Arumugam S. B., Cherian K. M.
Transmyocardial laser revascularization: early results and 1-year follow-up //
Ann. Thorac. Surg. — 1999. — Vol.67, №2. — P. 432-436.
29.
Allen
K. B., Dowling R. D., Heimansohn D. A., Reitsma E., Didelot L. T., Shaar C. J.
Clinical experience with transmyocardial revascularization utilizing a Holmium:
YAG laser // Presented at the American College of Cardiology 47th Annual
Scientific Session Atlanta, Georgia, 1998.
30.
Allen
K. B., Dowling R. D., Heimansohn D. A., Reitsma E., Didelot L., Shaar C. J.
Transmyocardial revascularization utilizing a holmium:YAG Laser // Eur. J.
Cardiothorac. Surg. – 1998. – Vol. 14, (Suppl. I). – P. 100-104.
31.
Allen
K. B., Fudge T. L., Selinger S. L., Dowling R. D. Prospective randomized
multicenter trial of transmyocardial revascularization versus maximal medical
management in patients with Class IV angina // Presented at the American Heart
Association Scientific Sessions, Orlando, Florida, 1999.
32.
Andreasen
J.J. Transmyocardial laser revascularization. A new possible method for
treatment of ischemic heart disease // Ugeskr Laeger. – 1996. – Vol. 158, №26.
– Р. 3764-3767.
33.
Baumgartner
H., Porenta G., Lau Y.-K. et. al. Assessment of myocardial viability by
dobutamine echocardiography, positron tomography and thallium — 201 SPECT:
Correlation with histopathology in explanted hearts. J. Am. Coll. Cardiol.,
1998; 3, 6: 1701-1708.
34.
Beck
C.S. The development of a new blood suuply to the heart by operation // Ann.
Surg. – 1935. – Vol. 102. – P. 801-813.
35.
Bonn
D. High-power lasers help the ischemic heart [news] // Lancet. – 1996. – Vol.
348. – P. 9020.
36.
Brilla
C.G., Rupp H., Gehrke D., Rybinski L. Transmyocardial laser revascularization –
an innovative pathophysiologic concept // Herz. – 1997. – Vol.22, №4. – Р. 183-189.
37.
Burkhoff
D., Smith C.R., DeRosa C.M., Kohmoto T., Apfelbaum M., Fisher P,E. Histologic appearance
of transmyocardial laser channels after 4 1/2 weeks // Ann. Thorac. Surg. –
1996. – Vol.61, №5. – P. 1532-1534.
38.
Burkhoff
D., Wessley M. N., Reser J. R., Lansing A. M. Factors correlating with risk of
following transmyocardial revascularization. J. Am. Coll. Cardiol., 1999; 34:
55-61.
39.
Burns
S., Sharples L. D., Tait S., Caine N., Wallwork J., Schefield P. M. The
transmyocardial laser revascularization international registration report. Eur.
Heart J., 1999; 20 — 1: 31-37.
40.
Campeau
L. Grading of angina pectoris // Circulation. – 1976. – Vol.54. – P. 522-523.
41.
Carlson
P.C. Patient care and expectations for recovery after transmyocardial laser
revascularization // AACN. Clin. Issues. – 1997. – Vol.8, №1. – P. 33-40.
42.
Chu V.
F., Giaid A. et al. Angiogenesis in transmyocardial revascularization:
comparison of laser versus mechanical punctures // Ann. Thorac. Surg. – 1999. –
Vol.68. – P. 301-308.
43.
Cooley
D.A. Revascularization of the ischemic myocardium: current results and
expectations for the future // Cardiology. – 1987. – Vol.74, №4. – P. 275-285.
44.
Cooley
D.A., Angelini P., Shannon R.L., Pehlivanoglu S., Kadipasaoglu K.A., Frazier
O.H. Transmyocardial laser revascularization. Anatomic evidence of long-term
channel patency // Tex. Heart. Inst. J. – 1994. – Vol.21, №3. – P. 220-224.
45.
Cooley
D.A., Moore W.H., Wilansky S., Kolff J.W., Pehlivanoglu S., Lindenmeir M.H.,
Kadipasaoglu K.A., Frazier O.H. Transmyocardial laser revascularization:
clinical experience with twelve-month follow-up // J. Thorac. Cardiovasc. Surg.
— 1996. – Vol.111, №4. – P. 791-797.
46.
Cottier
C., Klowski W., von Bertrab R., Phisterer M., Burkart F. Multiple coronary
arteriocameral fistulas as a cause of myocardial ischemia // Am. Heart. J. –
1988. – Vol.115, №1. – (Suppl I). – P. 181-184.
47.
Crew
J.R. Transmyocardial laser revascularization by CO2 laser // Surgery Technology
International. – 1991. — Vol.1. – P. 236-238.
48.
Crew
J.R., Thuener M., Jones R., Ryan C., Chimenti C., Fisher J.C. Transmyocardial
revascularization // J. Am. Coll. Cardiol. – 1994. – Vol.23. — (Suppl). – P.
151A.
49.
Dedic
K. Transmyocardial laser revascularization-histopathologic findings // Cesk.
Patol. – 1997. – Vol.33, №2. – P. 57-60.
50.
deGuzman
B.J., Cohn L.H., Horvath K.A., Ahmad R.M., Laurence R.G., Chen F.Y., Lautz D.B.
Thoracoscopic transmyocardial laser revascularization // Ann. Thorac. Surg. –
1997. – Vol.64, №1. – P. 171-174.
51.
Diegeler
A. Clinical outcomes after TMR with the Holmium: YAG laser. // Presented at:
TMR. The Holmium: YAG laser. Clinical outcomes and comparative studies.
Prague., 1996.
52.
Diegeler
A., Schneider J., Lauer B., Mohr F.W., Kluge R. Transmyocardial laser
revascularization using the Holmium-YAG laser for treatment of end stage
coronary artery desease // Eur. J. Cardiothorac. Surg. – 1998. – Vol.13. – P.
392-397.
53.
Donatelli
F., Triggiani M., D’Ancona G., Blasio A., Santoro F., Marchetto G., Benussi S.,
Grossi A. Transmyocardial laser revascularization in patients with peripheral
coronary atherosclerosis. Indications and preliminary results // G. Ital.
Cardiol. – 1997. – Vol.27, №5. – P. 430-435.
54.
Donovan
C.L., Landolfo K.P., Lowe J.E., Clements F., Coleman R.B., Ryan T. Improvement
in inducible ischemia during dobutamine stress echocardiography after
transmyocardial laser revascularization in patients with refractory angina
pectoris // J. Am. Coll. Cardiol. – 1997. – Vol.30, №3. – P. 607-612.
55.
Dowling
R. D., Petracek M. R., Selinger S. L., Allen K. B. Transmyocardial
revascularization with a Holmium laser in patients with refractory angina who
are unstable // Presented at the American Heart Association Scientific
Sessions, Orlando, Florida, 1997.
56.
Eckstein
F.S., Scheule A.M., Vogel U., Schmid S.T., Jurman M.J., Ziemer G.
Transmyocardial laser revascularization with the Holmium:YAG laser in the acute
ischemic heart does neither improve acute myocardial perfusion nor does it
prevent from myocardial infarction. An experimental study // In 12th Annual
Meeting of the Europ. assoc. for cardio-thorac. surg. (Brussels, 1998). —
Abstracts. — №006. — P. 84-85.
57.
Eichtadt
H. Methods of Nuclear Medicine to Verify Vitality and Efficacy of TMLR. // in
M. Klein., H. D. Schulte, E. Gums (Eds) Transmyocardial laser
revascularization. Berlin, Shprihger, 1998, pp. 47-63.
58.
Effler
D.B. Myocardial revascularization: direct or indirect? // J. Thorac.
Cardiovasc. Surg. – 1971. – Vol.61. – P. 498-500.
59.
Favaloro
R.G. Saphenous vein graft in the surgical treatment of coronary artery disease
— operative technique // J. Thorac. Cardiovasc. Surg. – 1969. – Vol.58. – P.
178-185.
60.
Figuera
A.D. Transmyocardial revascularization or the «reptilization» of the
myocardium: a new experience // An. R. Acad. Nac. Med. (Madr.). — 1994. –
Vol.111, №4. – P. 711-718.
61.
Fisher
J.C. The History of Transmiocardial revascularization in M.Klein, H.D.Shulte,
E.Gams (EDS) TMR-management of coronary artery disease. – Springer, Berlin. —
1998. — pp.111-121.
62.
Fisher
P.E., Burkhoff D., Smith C.R., Spotnitz H.M., DeRosa C.M., Khomoto T.
Histologic analysis of transmyocardial channels: comparison of CO2 and
holmium:YAG lasers // Ann. Thorac. Surg. – 1997. – Vol.64, №2. – P. 466-472.
63.
Fleischer
K.J., Baumgartner W.A., Hruban R.H., Hutchins G.M., Fonger J.D.,
Goldschmidt-Clermont P.J. One-month histologic response of transmyocardial
laser channels with molecular intervention // Ann. Thorac. Surg. – 1996. –
Vol.62, №4. – P. 1051-1058.
64.
Frazier
O.H., Moore W.H., Wilansky S., Conger J.L., Barasch E., Lindenmeir M.,
Pehlivanoglu S., Kadipasaoglu K.A., Cooley D.A. Myocardial revascularization
with laser. Preliminary findings // Circulation. – 1995. – Vol.92., №9. —
(Suppl II). – P. 58-65.
65.
Frazier
O.H., Kadipasaoglu K. Transmyocardial laser revascularization // Curr. Opin.
Cardiol. – 1996. – Vol.11, №6. – P. 564-567.
66.
Frazier
O.H., Kadipasaoglu K.A., Radovancevic B., Cihan H.B., March R.J., Mirhoseini
M., Cooley D.A. Transmyocardial laser revascularization in allograft coronary
artery disease // Ann. Thorac. Surg. – 1998. – Vol.65, №4. – P. 1138-1141.
67.
Freedom
R.M., Wilson G., Trusler G.A., Williams W.G., Rowe R.D. Pulmonary atresia and
intact ventricular septum // Sean. J. Cardiovasc. Surg. – 1983. – Vol.17. – P.
1-28.
68.
Funck
R.C., Maisch B., Moosdorf R., Bethge C., Hoffken H., Farokhzad F., Ketteler K.,
Holland A., Welzel K., Konig H., Rybinski L. Patients’ profiles in end stage
coronary artery disease. Indications for treatment with transmyocardial laser
revascularisation // Herz. – 1997. – Vol.22, №4. – P. 190-197.
69.
Galli
M, Mameli S, Butti E, Bonatti R, Politi A, Zerboni S, Ferrari G. Hypothesis and
development of a minimally invasive approach for percutaneous transmyocardial
revascularization with holmium laser // Ital Heart J 2001 Apr; 2(4): 312-6.
70.
Gassler
N., Helmchen U., Wullbrand A., Stubbe H.M., Wintzer H.O. Transmyocardial laser
revascularization. Histological features in human nonresponder myocardium // Circulation.
– 1997. – Vol.95, №2. – P. 371-375.
71.
Gassler
N., Stubbe H.M. Clinical data and histological features of transmyocardial
revascularization with CO2-laser // Eur. J. Cardiothorac. Surg. – 1997. –
Vol.12, №1. – P. 25-30.
72.
Gittenberger-de-Groot
A.C., Sauer U., Bindl L. et al. Competition of coronary arteries and
ventriculo-coronary arterial communications in pulmonary atresia with intact
ventricular septum // Int. J. Cardiol. – 1988. – Vol.18. – P. 243-258.
73.
Goda
T., Loisance D., Vouron J., Leandri J., Gaston A., Wierzbicki Z. Myocardial
revascularization by CO2 laser // Eur. Surg. Res. – 1987. – Vol.19, №2. – P.
113-117.
74.
Goldman
A., Greenstone S.M., Preuss F.S., Strauss S.H., Chang E.S. Experimental methods
for producing a coronary collateral circulation to the heart directly from the
left ventricle // J. Thoracic. Surg. – 1956. – Vol.31. – P. 364-374.
75.
Grocott
H.P., Newman M.F., Lowe J.E., Clements F. Transmyocardial laser
revascularization: an anesthetic perspective // J. Cardiothorac. Vasc. Anesth.
– 1997. – Vol.11, №2. – P. 206-210.
76.
Grondeman
P.F., van Leeuwen T.G., Verdaasdonk R.M. et al. Toracoscopic creation of
transmural laser channels in the beating porcine heart using conventional
lasers: closed chest application of the cardiac immobilization method //
Abstracts of XVIIIth Congress of the Europ. Soc. of Cardiology (25-29 August
1996, Birmingham, UK). — P. 806.
77.
Guo J.
A canine trial using transventricular laser channel // Chung. Hua. Hsin. Hsueh.
Kuan. Ping. Tsa. Chih. – 1991. – Vol.19, №3. – P. 158-160, 197-198.
78.
Guo
J.X., Shi A.Y., Xu H., Chen M.Z., Ma L., Pan J. Experimental studies of laser
myocardial revascularization in rats // Chin. Med. J. – 1993. – Vol.106, №9. –
P. 665-667.
79.
Haghes
GC., Shah A., Yin B., Shu M., Donovan CL., Glower D.D., Lowe J.E., Landolfo
K.P. Early postoperative changes in regional systolic and diastolic left
ventricular function after transmyocardial laser revascularization. // Journal
of the American College of Cardiology, Vol 35, №4, 2000.
80.
Hardy
R.I., Goldman L., Kaplan S., James F.W., Bove K.E. A histologic study of
laser-induced transmyocardial channels // Lasers. Surg. Med. – 1987. – Vol.6,
№6. – P. 563-573.
81.
Hardy
R.I., Kaplan S., Millard R.W., James F.W. Regional myocardial blood flow and
cardiac mechanics in dog hearts with CO2 laser-induced intramyocardial
revascularization // Basic. Res. Cardiol. – 1990. – Vol.85, №2. – P. 179-197.
82.
Hattler
B. G., Griffith B. P., Zenati M.A., et al. Transmyocardial Laser
Revascularization in the Patients With Unmanageable Unstable Angina. Ann.
Thorac. Surg., 1999; 68: 1203-1209.
83.
Hershey
J.E., White M. Transmyocardial puncture revascularization: a possible emergency
adjunct to arterial implant surgery // Geriatrics. – 1969. – Vol.24. – P.
101-108.
84.
Hirsch
G. M., Thompson G. W., Arora R. C. et al. Transmyocardial laser
revascularization does not denervate the canine heart // Ann. Thorac. Surg. –
1999. – Vol. 68. – P. 460-469.
85.
Hoffmann
E., Gebhardt C., Prьckner J., Oppermann C.,
Purschke R.. Die revaskularisation des herzmuskels im tierexperiment // Arch.
Kreislaufforschg. – 1971. – Vol.66. – P. 130-142.
86.
Horvath
K.A., Smith W.J., Laurence R.G., Byrne J.G., Schoen F.J., Cohn L.H. Improved
short- and long term recovery after an acute myocardial infarct treated by
transmyocardial laser revascularization // Surg. Forum. – 1993. – Vol.44. – P.
220-222.
87.
Horvath
K.A., Cohn L.H., Appleyard R.F., Schoen F.J., Laurence R.G., Smith W.J.
Recovery and viability of an acute myocardial infarct after transmyocardial
laser revascularization // J. Am. Coll. Cardiol. – 1995. – Vol.25, №1. – P.
258-263.
88.
Horvath
K. A., Mannting F., Cummings N. et al. Transmyocardial laser revascularization:
operative technics and clinical results of two years. J. Thorac. Cardiovasc.
Surg., 1996; III: 1047-1053.
89.
Horvath
K.A., Cohn L.H., Cooley D.A., Crew J.R., Frazier O.H., Griffith B.P.,
Kadipasaoglu K., Lansing A., Mannting F., March R., Mirhoseini M.R., Smith C.
Transmyocardial laser revascularization: results of a multicenter trial with
transmyocardial laser revascularization used as sole therapy for end-stage
coronary artery disease // J. Thorac. Cardiovasc. Surg. – 1997. – Vol.113, №4.
– P. 645-653.
90.
Hudson
C.L., Moritz A.K., Wearn J.T. The extracardiac anastomoses of the coronary
arteries // J. Exp. Med. – 1932. – Vol.56. – P. 919-925.
91.
Hughes
G. C., Donovan C. L., Lowe J. E., Landolfo K.P. Combined TMR and Mitral Valve
Replacement via Left Thoracotomy // Ann. Thorac. Surg. – 1998. – Vol.65, №4. –
P. 1141-42.
92.
Jacques
S.L. Laser-tissue interactions: photochemical, photothermal and photomechanical
// Surg. Clin. North. Am. — 1992. — Vol.72. — P. 531-558.
93.
Jeevanandam
V., Auteri J.S., Oz M.C., Watkins J.F., Rose E., Smith C.R. Myocardial
revascularization by laser induced channels // Surg. Forum. — 1991. — Vol.41. —
P. 225-227.
94.
Jones
E. L., Craver J. M., Guyton R. A., et al. Importance of complete
revascularization. in perfomance of the coronary bypass operation. Am. J
Cardiol. 1983; 51: 7-12.
95.
Kadipasaoglu
K.A., Frazier O.H., Cooley D.A., Clubb F.J. Jr., Piluiko V., Cloy M., de
Villalobos D.H., Sasaki E., Conger J.L., Pehlivanoglu S. Long- and short-term
effects of transmyocardial laser revascularization in acute myocardial ischemia
// Lasers. Surg. Med. — 1997. — Vol.20, №1. — P. 6-14.
96.
Kadipasaoglu
K. A., Sartori M., Masai T., Cihan H. B., Clubb F. J., Conger J. L., Frazier O.
H. Intraoperative arrhythmias and tissue damage during transmyocardial laser
revascularization // Ann. Thorac. Surg. — 1999. — Vol.67, №2. — P. 423-431.
97.
Kanellopoulos
G.K., Hebekk A., Svindland A., Kvernebo K. Endocardial laser treatment reduces
left ventricular contractility in an acute porcine model of regional
hypoperfusion // In 12th Annual Meeting of the Europ. assoc. for cardio-thorac.
surg. (Brussels, 1998). — Abstracts. — №129. — P. 330-331.
98.
Kanellopouls
G. K., Svindland A., Tjonsland O. et al. Transmyocardial laser treatment
damages intramyocardial nerve axons but spares epicardial pericoronary nerves
// In: 13th Annual Meeting of the SACTS. — Abstracts. — Glasgow, 1999. — №180.
— P. 458.
99.
Khazei
A.H., Kime W.P., Papadopoulos C., Cowley R.A. Myocardial canalization: a new
method of myocardial revascularization // Ann. Thorac. Surg. — 1968. — Vol.6,
№2. — P. 163-171.
100. Kim C.B., Oesterle S.N.,
Kernoff R., Billingham M.E., Walton A.S., Hayase M., Javier M., Kesten R.
Percutaneous method of laser transmyocardial revascularization // Cathet.
Cardiovasc. Diagn. — 1997. — Vol.40, №2. — P. 223-228.
101. Kipfer B., Althaus U.,
Schupbach P., Carrel T. Current techniques in heart surgery // Schweiz.
Rundsch. Med. Prax. — 1997. — Vol.86, №17. — P. 700-703.
102. Klein M., Dauben H. P.,
Schulte H. D. Transmyocardial laser revascularization in patients with
end-stage coronary artery desease // Cardiovasc. Surg. – 1996. – Vol. 4, (Suppl
I). – P. 15.
103.
Klein M.
Трансмиокардиальная лазерная реваскуляризация. Трехлетний опыт. // [Лекция]. —
Вторая ежегодная сессия НЦ ССХ им. А.Н. Бакулева., Москва, 1998, — программа. —
С. 58.
104. Klein M., Dauben H.P.,
Schulte H.D., Gams E. Transmyocardial Laser Revascularization: Clinical
Concerning the Use of an Eximer Laser System. In M. Klein., H. D. Schulte, E.
Gums (Eds) Transmyocardial laser revascularization. Berlin, Shpringer, 1998.
pp. 201-213.
105. Knopf W., Londero H.,
Allende S. Feasibility study of percutaneous transluminal myocardial
revascularization with the Holmium laser and fiberoptic delivery system //
Presented at Transcatheter Cardiovascular Therapeutics (TCT) Washington, D.C.,
1997
106. Knopf W., Londero H., Kaul
U., O’Neill W., Shawl F. A. Feasibility study of percutaneous transluminal
myocardial revascularization (PTMR) with a Holmium laser and fiberoptic
delivery system // Presented at the American College of Cardiology 47th Annual
Scientific Session, Atlanta, Georgia, 1999
107. Kohmoto T., Burkhoff D.,
Smith C.R., Spotnitz H.M., Yano O.J., Zhu S.M., Gu A., Fisher P.E. Does blood
flow through holmium:YAG transmyocardial laser channels? // Ann. Thorac. Surg.
— 1996. — Vol.61, №3. — P. 861-868.
108. Kohomoto T., De Rosa C.
M., Yamamoto N., Fisher P. E., Failey P., Smith C. R., Burkoff D. Evidence of
vascular growth associated with laser treatment of normal canine myocardium //
Ann. Thorac. Surg. – 1998. – Vol.65, №5. – P. 1360-67.
109. Krabatsch T., Talsner J.,
Hempel B. et al. Histological findings after transmyocardial laser
revascularization (TMLR) with the Heart laser. // In 5th Intern. TMR Symposium,
Paris, 1995.
110. Krabatsch T., Hempel B.,
Hofmeister J., Lieback E., Muller J., Hetzer R. Transmyocardial laser
revascularization in the treatment of diffuse coronary artery disease — early
clinical results. 9-th Annualn Meeting of the European Assciation for
Cardiothoracic Surgery. Paris, France, 1995: 362, №P153.
111. Krabatsch T., Hetzer R.,
Thalmann U., Tulsner J., Leder C., Schaper F. Histological findings after
transmyocardial laser revascularization // J. Card. Surg. — 1996. — Vol.11, №5.
— P. 326-331.
112. Krabatsch T. et. al. Die
transmyokardiale Laserrevascularisation in der Therapie der Diffusen Koronaren
Herzerkcrancung. // Z.Herz-, Thorax-, Gefachir. – 1996. H.10. – S.19-26.
113. Krabatsch T., Hetzer R.,
Thalmann U., Leder C., Tambeur L., Schaper F. Histomorphology after
transmyocardial laser revascularization // Herz. — 1997. — Vol.22, №4. — P.
205-20.
114. Kruse T., Maisch B.,
Bethge C., Moosdorf R., Hoffken H. Transmyocardial laser revascularization and
rehabilitation // Herz. — 1997. — Vol.22, №4. — P. 211-216.
115. Kuzela L., Miller G.E.
Experimental evaluation of direct transventricular revascularization // J.
Thorac. Cardiovasc. Surg. — 1969. — Vol.57. — P. 770-773.
116. Kwong K. F., Schuessler R.
B., Kanellopoulos G. K., Saffitz J. E. et al. Nontransmural laser treatment
incompletely denervates canine myocardium // Circulation. — 1998. — Vol. 98,
№19, (Suppl II). — P. 67-71.
117. Landreneau R., Curtis J.,
McKown D., McDaniel W., Brown O., Ripperger J., Laughlin H., Nawarawong W. Direct
CO2 laser «revascularization» of the myocardium // Lasers. Surg. Med.
— 1991. — Vol.11, №1. P. 35-42.
118. Lansing A.M., Singh S.,
Lash J.A. Transmyocardial revascularization for intractable angina // J. Ky.
Med. Assoc. — 1996. — Vol.94, №10. — P. 432-436.
119. Lansing A. M. Transmyocardial
laser revascularization. (Correspondence). Lancet, 1999; 353: 1705.
120. Lansing A.M.,
Transmyocardial Laser Revascularization, Ann Thorac Surg — 2000; 70: 1763.
121. Lary B.G. Effect of
endocardial incisions on myocardial blood flow // Arch. Surg. — 1963. — Vol.87.
— P. 82-85.
122. Lawrie G. M., Morris G. C
Jr., Silvers A., et al. The influence of the residual disease after coronary
bypass on the 5-year survival rate of 1274 men with coronary artery disease.
Circulation, 1982; 66: 717-723.
123. Li W., Chiba Y., Kimura
T., Morioka K., Uesaka T., Ihaya A., Muraoka R. Transmyocardial laser
revascularization induced angiogenesis correlated with the expression of matrix
metalloproteinases and platelet-derived endothelial cell growth factor // European
Journal of Cardio-thoracic Surgery 19 (2001) 156-163.
124. Lutter G., Frey M.,
Saurbier B., Nitzsche E., Hoegerle S. et al. Treatment strategies in therapy
refractory angina pectoris: transmyocardial laser revascularization // Z.
Kardiol. — 1998. — Vol. 87, (Suppl 2). — P.199-202.
125. Lutter G., Schwarzkopf J.,
Lutz C., Martin J., Beyersdorf F. Histologic findings of transmyocardial laser
channels after two hours // Ann. Thorac. Surg. – 1998. – Vol.65, №5. – P.
1437-1439.
126. Mack C. A., Patel S. R.,
Rosengart T.K. Myocardial angiogenesis as a possible mechanism for TMLR
efficacy // J. Clin. Laser. Med. Surg. — 1997. — Vol.15, №6. — P. 275-9.
127. Mack C.A., Magovern C.J.,
Hahn R.T., Sanborn T., Lanning L., Ko W., Isom O.W., Rosengart T.K. Channel patency
and neovascularization after transmyocardial revascularization using an excimer
laser. Results and comparisons to nonlased channels // Circulation. — 1997. —
Vol.96. — [Suppl II]. — P. 65-69.
128. Maisch B., Funck R.,
Schunian U., Moosdorf R. Indications for transmyocardial laser therapy // Z.
Kardiol. — 1996. — Vol.85. — [Suppl 6]. — P. 269-279.
129. Malik F.S., Mehra M.R.,
Ventura H.O., Smart F.W., Stapleton D.D., Ochsner J.L. Management of cardiac
allograft vasculopathy by transmyocardial laser revascularization // Am. J.
Cardiol. — 1997. — Vol.80, №2. — P. 224-225.
130. March R.J., Aranki S.,
Boyce S., Cohn L.H., Cooley D.A., Crew J.R., Fontana G., Frazier O.H., Griffith
B.P., Landolfo K.P., Lansing A, Lowe J, Lytle B., Mirhoseini M., Smith C. Improved
event free survival following transmyocardial laser revascularization versus
medical management in patients with unreconstructed coronary artery disease //
American Association for Thoracic Surgery 77th., Annual Meeting. — 1997. — P.
96.
131. March R. J.
Transmyocardial laser revascularization with the CO2 laser: one year results of
a randomized, controlled trial. Seminars Thorac. Cardiovasc. Surg. 1999; 11:
12-18.
132. Martin L. G., Von Specht
M. J., Buerkle M., Samson P., Geiger A. et al. Evaluation of the new indirect
revascularization method (TMLR) after 3 months chronic myocardial ischemia //
In: 13th Annual Meeting of the SACTS. — Abstracts. — Glasgow, 1999. — №174. —
P. 446.
133. Massimo C., Boffi L.
Myocardial revascularization by a new method of carrying blood directly from
the left ventricular cavity into the coronary circulation // J. Thoracic. Surg.
— 1957. — Vol.34. — P. 257-264.
134. Milano A., Bortolotti U.,
Pietrabissa A. Transmyocardial laser revascularization using a thoracoscopic
approach // Am. J. Cardiol. — 1997. — Vol.80, №4. — P. 538-539.
135. Mirhoseini M., Cayton M.M.
Revascularization of the heart by laser // J. Microsurg. — 1981. — Vol.2, №4. —
P. 253-260.
136. Mirhoseini M., Cayton
M.M., Muckerheide M. Transventricular revascularization by laser // Lasers.
Surg. Med. — 1982. — Vol.2, №2. — P. 187-198.
137. Mirhoseini M. Laser
applications in thoracic and cardiovascular surgery // Med. Instrum. — 1983. —
Vol.17, №6. — P. 401-403.
138. Mirhoseini M., Cayton M.,
Fisher J.C. Myocardial revascularization by laser: a clinical report // Lasers.
Surg. Med. — 1983. — Vol.3, №3. — P. 241-245.
139. Mirhoseini M., Fisher
J.C., Shelgikar S., Cayton M.M. Laser myocardial revascularization // Lasers.
Surg. Med. — 1986. — Vol.6, №5. — P. 459-461.
140. Mirhoseini M., Cayton
M.M., Shelgikar S. New concepts in revascularization of the myocardium // Ann.
Thorac. Surg. — 1988. — Vol.45, №4. — P. 415-420.
141. Mirhoseini M., Cayton M.
M., Wann L. S., Wilke N. M. et al. Transmyocardial laser revascularization
improves myocardial blood flow in chronic ischemia // In: 13th Annual Meeting
of the SACTS. — Abstracts. — Glasgow, 1999. — №166. — P. 712.
142. Moosdorf R.
Transmyocardial revascularization // Z. Kardiol. — 1997. — Vol.86. — [Suppl 1].
— P. 115-124.
143. Moosdorf R., Hort W.,
Schoebel F.C. Transmyocardial laser revascularization—morphologic,
pathophysiologic and historical principles of indirect revascularization of the
heart muscle // Z. Kardiol. — 1997. — Vol.86, №3. — P. 149-164.
144. Moosdorf R., Maisch B.,
Funck R.C., Hoffken H., Rybinski L. Transmyocardial laser revascularization in
stable and unstable angina pectoris // Herz. — 1997. — Vol.22, №4. — P.
198-204.
145. Mueller X. M., Bettex D.,
Tevaearai H. T., von Segesser L. K. Acute effects of transmyocardial laser
revascularization on left-ventricular function: an haemodynamic and
echocardiographic study // Thorac. Cardiovasc. Surg. — 1998. — Vol. 46, №3. —
P.126-9.
146. Mueller X. M., Tevacarai
H. T., Genton C. Y., Chaubert P. et al. Improved neoangiogenesis in TMLR
combined with angiogenetic adjunct // In: 13th Annual Meeting of the SACTS. —
Abstracts. — Glasgow, 1999. — №673. — P. 246.
147. Mueller X.M., Tevaearai
H.H., Genton C.Y., Bettex D., von Segesser L.K. Transmyocardial laser
revascularisation in acutely ischaemic myocardium // Eur. J. Cardiothorac.
Surg. — 1998. — Vol.13, №2. — P. 170-175.
148. Mulcahy D., Knight C.,
Stables R., Fox K. Lasers, burns, cuts, tingles and pumps: a consideration of
alternative treatments for intractable angina [editorial] [see comments] // Br.
Heart. J. — 1994. — Vol.71, №5. — P. 406-407.
149. Nagele H., Kalmar P.,
Nienaber C.A., Rodiger W., Stubbe H.M. Place of trans-myocardial laser
revascularization in treatment-resistant coronary heart disease // Dtsch. Med.
Wochenschr. — 1997. — Vol.122, №37. — P. 1117-1120.
150. Nagele H., Stubbe H.M.,
Stiel G.M., Rodiger W., Nienaber C.A., Marcsek P., Lubeck M., Kalmar P.
Transmyocardial laser revascularization — a treatment option for coronary heart
disease? // Z. Kardiol. — 1997. — Vol.86, №3. — P. 171-178.
151. Naprstek Z., Rockwell R.J.
Some laser applications in cardiovascular research // Int. Congr. Med. Eng.
Session. — 1969. — Vol.1. — P. 34-36.
152. O’Connor W.N., Cash J.B.,
Cottrill C.M., Johnson G.L., Noonan J.A. Ventriculocoronary connections in
hypoplastic left hearts: An autopsy microscopic study // Circulation. — 1982. —
Vol.66. — P. 1078-1086.
153. O’Connor W.N., Stehr A.J.,
Cottrill C.M., Todd E.P., Noonan J.A. Ventriculocoronary connections in
hypoplastic right heart syndrome: Autopsy section study of six cases // J. Am.
Coll. Cardiol. — 1988. — Vol.11. — P. 1061-1072.
154. Oesterle S.N., Walton
A.J., Kernoff R., et al. Percutaneous trans-endocardial laser revascularization
// Circulation. — 1995. — Vol.92. — (Suppl 1). — P. 616.
155. Okada M. Transmyocardial
laser revascularization (TMLR): a long way to the first successful clinical
application in the world // Ann. Thorac. Cardiovasc. Surg. — 1998. — Vol.4, №3.
— P. 119-24.
156. Okada M., Ikuta H., Horii
H., Shimizu K., Nakamura K. A new method of myocardial revascularization by CO2
laser // Kyobu. Geka. — 1984. — Vol.37, №2. — P. 100-105.
157. Okada M., Ikuta H.,
Shimizu K., Horii H., Nakamura K. Alternatives method of myocardial
revascularization by laser: experimental and clinical study // Kobe. J. Med.
Sci. — 1986. — Vol.32, №5. — P. 151-161.
158. Okada M., Nakamura K.,
Horii H., Ikuta H., Shimizu K. A new method of myocardial revascularization by
laser // Thorac. Cardiovasc. Surg. — 1991. — Vol.39, №1. — P. 1-4.
159. Okada M., Nakamura M.
Experimental and clinical studies on transmyocardial laser revascularization
(TMLR) // J. Clin. Laser. Med. Surg. — 1998. — Vol.16, №4. — P. 197-201.
160. Owen E.R., Hopwood P.R.,
Bryant K., Canfield P. Observations on the effects of CO2-laser on rat
myocardium // Microsurgery. — 1984. — Vol.5, №3. — P. 140-143.
161. Ozaki S., Meyns B.,
Verbeken E. et al. Transmyocardial laser revascularization in a sheep model of
ischemic cardiomyopathy // In: 13th Annual Meeting of the SACTS. — Abstracts. —
Glasgow, 1999. — №264. — P. 526.
162. Patel V.S., Radovancevic
B., Springer W., Frazier O.H., Massin E., Benrey J., Kadipasaoglu K., Cooley
D.A. Revascularization procedures in patients with transplant coronary artery
disease // Eur. J. Cardiothorac. Surg. — 1997. — Vol.11, №5. — P. 895-901.
163. Pifarre R., Jasuja M.L.,
Lynch R.D., Neville W.E. Myocardial revascularization by transmyocardial
acupuncture: a physiologic impossibility // J. Thorac. Cardiovasc. Surg. —
1969. — Vol.58. — P. 424-431.
164. Reuthebuch O., Podzuweit
T., Binz K., Thomas S., Muller A., Roth M., Klovehorn W.P., Baner E.P. Effects of transmyocardial laser
revascularization on high-energy phosphate catabolism in acute myocardial
ischemia in pigs // In 12th Annual Meeting of the Europ. assoc. for
cardio-thorac. surg. (Brussels, 1998). — Abstracts. — №032. — P. 136.
165. Reuthebuch O., Podzuweit
T., Thomas S., Binz K. et al. Transmyocardial laser revascularization has no
beneficial effect on high energy phosphates and lactate content during acute
myocardial ischemia in pigs // Eur. J. Cardiothorac. Surg. – 1999. – Vol. 16,
№2. – P. 144-149.
166. Robicsek F. Minimally
invasive MIDCABG and TMLR [letter] // Ann. Thorac. Surg. — 1999. — Vol. 67, №3.
— P. 892.
167. Ryan TJ., Anderson JL.,
Antman E.M. et al. ACC/AHA Guidelines for the management of patients with acute
myocardial infarction. Circulation 1996; 94: 3341-3350.
168. Saatvedt K., Dragsund M.,
Nordstrand K. Transmyocardial laser revascularization and coronary artery
bypass grafting without cardiopulmonary bypass [letter] // Ann. Thorac. Surg. —
1996. — Vol.62, №1. — P. 323-324.
169. Sachinopoulou A.,
Verdaasdonk R., Rudolf M., Beek J. Comparison of ablation channels created by
the ultrapulsed CO2 laser, holmium laser, and 308-nm excimer laser in view of
transmyocardial revascularization // Lasers in Surgery. — 1996. — Proc SPIE. —
Vol. 2671. — P. 42-47
170. Salomon N.W., Page U.S.,
Bigelow J.C., Krause A.H., Okies J.L., Metzdorff M.T. Reoperative coronary
surgery. Comparative analysis of 6591 patients undergoing primary bypass and
508 patients undergoing reoperative coronary artery bypass // J. Thorac.
Cardiovasc. Surg. — 1990. — Vol.100. — P. 250-260.
171. Schaff H. V., Gersh B. J.,
Pluth J. R., et al. Survival and functional status after coronary artery bypass
grafting: results 10 to 12 years after surgery in 500 patients. Circulation,
1983; 68(Suppl 2): 200-204.
172. Schmid C., Scheld H.H.
Trends and strategies for myocardial revascularization // Thorac. Cardiovasc.
Surg. — 1996. — Vol.44, №3. — P. 113-117.
173. Schoebel F.C., Jax T.W.,
Heintzen M.P., Strauer B.E., Leschke M., Frazier O.H., Kadipasaoglu K.A.,
Cooley D.A., Jessurun G.A.J., De Jongste M.J.L. Refractory angina pectoris in
end-stage coronary artery disease: evolving therapeutic concepts // Am. Heart.
J. — 1997. — Vol.134, №4. — P. 587-602.
174. Schofield P.M., Sharples
L.D., Caine N., Burns S., Tait S. et al. Transmyocardial laser
revascularisation in patients with refractory angina: a randomised controlled
trial // Lancet — 1999. — Vol. 353, №9152. — P.519-24.
175. Schweitzer W., Schneider
J., Maass D., Hardmeier T. Transmyocardial laser revascularization.
Histopathology of laser channels in 10 postoperatively deceased patients 1 to
18 days after treatment with a CO2 laser // Pathologe — 1997. — Vol.18, №5. — P.
374-84.
176. Sen P.K., Udwadia T.E.,
Kinare S.G., Parulkar G.B. Transmyocardial revascularization: a new approach to
myocardial revascularization // J. Thorac. Cardiovasc. Surg. — 1965. — Vol.50.
— P. 181-189.
177. Shawl F. A., Kaul U.,
Singh B., Rigali G. Percutaneous transluminal myocardial revascularization
(PTMR): Procedure results and early clinical outcome // Presented at the
American College of Cardiology 47th Annual Scientific Session, Atlanta,
Georgia, 1998
178. Smith G.T. The anatomy of
the coronary circulation // Am. J. Cardiol. — 1962. -Vol.9. — P. 327-342.
179. Smith J.A., Wallwork J.,
Large S.R., Parry A.J., Dunning J.J. Transmyocardial laser revascularization //
J. Card. Surg. — 1995. — Vol.10, №5. — P. 569-572.
180. Sola O. M, Shi Q., Vernon
R.B. and Lazzara R.R. Cardiac Denervation After Transmyocardial Laser. //Ann
Thorac Surg 2001;71: 732.
181. Spanier T.,Smith C.
R.,Burkhoff D. Angiogenesis: a possible mechanism underlying the clinical
benefits of transmyocardial laser revascularization // J. Clin. Laser. Med.
Surg. — 1997. — Vol.15, №6. — P.269-73.
182. Steiner I., Hrubeky J. et
al. Persistence of spongy myocardium with embryonic blood supply in an adult //
Cardiovasc. Pathol. – 1996. – Vol.5, №1. – P. 47-53.
183. Svedjeholm R., Dahlin L.
G., Lundberg C. et al. Are electrocardiographic Q-wave criteria reliable for
diagnosis of perioperative myocardial infarction after coronary surgery? //
Eur. J. Cardiothorac. Surg. – 1998. – Vol. 13, №4. – P. 655–661.
184. Thrush D.N. Anesthesia for
laser transmyocardial revascularization // J. Cardiothorac. Vasc. Anesth. —
1997. — Vol.11, №4. — P. 481-484.
185. Trehan N., Mishra M.,
Kohli V.M., Mishra A., Jangid D.R., Bapna R. Transmyocardial laser
revascularisation as an adjunct to CABG // Indian Heart. J. — 1996. — Vol.48,
№4. — P. 381-388.
186. Trehan N., Mishra M.,
Bapna R., Mishra A., Maheshwari P., Karlekar A. Transmyocardial laser
revascularisation combined with coronary artery bypass grafting without
cardiopulmonary bypass // Eur. J. Cardiothorac. Surg. — 1997. — Vol.12, №2. —
P. 276-284.
187. Trehan N., Mishra M.,
Mehta Y., Yangid D. R. Transmyocardial laser as an adjunct to minimally
invasive CABG for complete myocardial revascularization // Ann. Thorac. Surg. –
1998. – Vol. 66. – P. 1113-1118.
188. Tsang J.C., Chiu R.C. The
phantom of «myocardial sinusoids»: a historical reappraisal // Ann.
Thorac. Surg. — 1995. — Vol.60, №6. — P. 1831-1835.
189. Uchino T, Beloul A,
Roberts D,Jagenburg K.Measurement of Myosin Light Chain I and troponin T as
markers of myocardial damage after cardiac surgery. // J Cardiovasc Surg 35 —
3: 201-206.
190. Verheul H.A., Moulijn
A.C., Hondema S., Schouwink M., Dunning A.J. Late results of 200 repeat
coronary bypass operations // Ann. J. Cardiol. — 1991. -Vol.67. — P. 24-30.
191. Vincent J.G., Bardos P.,
Kruse J., Maass D. End stage coronary disease treated with the transmyocardial
CO2 laser revascularization: a chance for the «inoperable» patient // Eur. J.
Cardiothorac. Surg. — 1997. — Vol.11, №5. — P. 888-894.
192. Vineberg A.M. Clinical and
experimental studies in the treatment of coronary artery insufficiency by
internal mammary artery implant // Journ. Intern. Coll. Surg. — 1954. — Vol.22,
№5. — P. 513-518.
193. Vineberg A.M. Development
of an anastomosis between the coronary vessels and a transplanted internal
mammary artery // Can. Med. Assoc. J. — 1946. — Vol.55. — P. 117-119.
194. Vineberg A.M., Baichwal
K.S., Myers J. Treatment of acute myocardial infarction by endocardial
resection // Surgery. — 1965. — Vol.57. — P. 832-835.
195. von Knobelsdorff G.,
Brauer P., Tonner P.H., Hafnel F., Naegele H., Stubbe H.M., Esch J.S.
Transmyocardial laser revascularization induces cerebral microembolization //
Anesthesiology. — 1997. — Vol.87, №1. — P. 58-62.
196. Wakabayashi A., Little
S.T., Conolly J.E. Myocardial boring for the ischaemic heart // Arch. Surg. —
1967. — Vol.95. — P. 743-752.
197. Walpoth B.H., Genuk J.,
Aeschbacher B., Frenz M., Schaffner Th., Althaus U., Carrel T. Comparison of 3
different laser techniques for Transmyocardial revascularization in the pig //
In 12th Annual Meeting of the Europ. assoc. for cardio-thorac. surg. (Brussels,
1998). — Abstracts. — №133. — P. 338.
198. Walter P., Hundeshagen H.,
Borst H.G. Treatment of acute myocardial infarction by transmural blood supply
from the ventricular cavity // Eur. Surg. Res. — 1971. — Vol.3. — P. 130-138.
199. Wang G., Liu W. Direct
revascularization of ischemic myocardium by laser // Chung. Hua. Wai. Ko. Tsa.
Chih. — 1995. — Vol.33, №4. — P. 243-245.
200. Wassmer P. C., Almanza O.,
Moreno C. A., Nunez E. Laser transmyocardial revascularization (LTMR) enhances
perfusion to ischemic myocardium // Presented at the American Heart Association
Scientific Sessions Orlando, Florida, 1997
201. Wassmer P., Almanza O.,
Moreno C. A., Nunez E., Revall S. E., Ochsner J., Cheirif J. Does Holmium laser
transmyocardial revascularization (LTMR) reduce infarct size? // Presented at
the American Heart Association Scientific Sessions Orlando, Florida, 1997
202. Wearns J.T., Mettier S.R.,
Klump T.G., Zschiesche A.B. The nature of the vascular communications between
the coronary arteries and the chambers of the heart // Am. Heart. J. — 1933. —
Vol.9. — P. 143-170.
203. Weber C., Maas R., Steiner
P., Beese M. et al. Transmyocardial laser revascularization—the initial
experiences of imaging in MRT // Rofo. Fortschr. Geb. Rontgenstr. Neuen.
Bildgeb. Verfahr. — 1998. — Vol.169, №3. — P. 260-6.
204. White M., Hershey J.E.
Multiple transmyocardial acupuncture revascularization in refractory
ventricular fibrillation due to myocardial ischemia // Ann. Thorac. Surg. —
1968. — Vol.6. — P. 557-563.
205. Whittaker P., Przyklenk
K., Kloner R.A. Laser-mediated transmural myocardial channels do not salvage
acutely ischemic myocardium [see comments] // J. Am. Coll. Cardiol. — 1993. —
Vol.22, №1. — P. 302-309. Comment in: J. Am. Coll. Cardiol. — 1994. — Vol.23,
№6. — P. 1518.
206. Whittaker P., Kloner R.A.,
Przyklenk K. Laser-mediated transmural myocardial channels do not selvage
acutely ischemic myocardium. J. Am. Coll. Cardiol., 1993, 22: 302-309.
207. Whittaker P., Kloner R.A.
Excimer laser channels protect against myocardial ischemia // J. Am. Coll.
Cardiol. — 1996. — Vol.27. — (Suppl A). — P. 13A.
208. Yamamoto N., Kohomoto T.,
Gu A., De Rosa C., Smith C. R., Burkoff D. Angiogenesis is enhanced in ischemic
canine myocardium by transmyocardial laser revascularization // JACC. — 1998. —
Vol.31, №6. — P. 1426-1433.
209. Yano O.J., Bielefeld M.R.,
Jeevanandam V., Treat M.R., Marboe C.C., Spotnitz H.M., Smith C.R. Prevention
of acute regional ischemia with endocardial laser channels // Ann. Thorac.
Surg. — 1994. — Vol.57. — P. 784-785.
210. Zheng S.M., Kloner R.A.,
Whittaker P. Ablation and coagulation of myocardial tissue by means of a pulsed
holmium: YAG laser // Am. Heart. J. — 1993. — Vol.126, №6. — P. 1474-1477.
