Патоморфологические изменения в органах крыс при моделировании
реперфузионного синдрома
В.З. Харченко, А.В. Кубышкин, Л.Л. Алиев, И.И. Фомочкина
Крымский государственный медицинский университет им. С.И. Георгиевского,
кафедра патологической физиологии, г. Симферополь
Реперфузионный синдром (РС) представляет собой сложный комплекс
нарушений, возникающих в результате восстановления кровотока в ранее
ишемизированной ткани. Расстройства, вызванные ишемией и последующей
реперфузией тканей, наблюдаются в кардиологической, ангиохирургической, травматологической,
неврологической практике [1, 2].
Патогенез ишемических и реперфузионных расстройств органов и тканей имеет
сложный и многокомпонентный характер. Важнейшая
роль в патогенезе реперфузионного синдрома принадлежит системной активации
протеолитических ферментов, которая происходит в результате повышения
проницаемости клеточных мембран, экзоцитоза лейкоцитов [3, 4, 5]. При этом повышение протеолитической активности в
сыворотке крови сопровождается угнетением функции сывороточных и тканевых
ингибиторов протеолиза [6, 7].
Высвобождение, активация и поступление протеолитических ферментов в системный
кровоток приводит к нарушению функции калликреин-кининовой системы, свертывания
крови, системы комплемента [4].
Регуляторные плазменные системы влияют на активность тканевых базофилов,
тромбоцитов, макрофагов, моноцитов, способных выделять мощные медиаторы воспаления
[8]. Кроме того, развитие РС сопровождается интенсификацией процессов свободнорадикального
окисления (СРО) липидов [9, 10].
С учетом механизмов развития реперфузионного синдрома, при формировании
которого происходит накопление и массивное поступление в системный кровоток
биологически активных веществ, характерных для воспалительного процесса, можно
предположить, что при изучаемой патологии возникает системная воспалительная
реакция, которая может быть ключевым фактором в развитии органопатологии при
критических состояниях.
Основная сущность синдрома системной воспалительной реакции (ССВР)
заключается в генерализации базисных механизмов воспалительного процесса,
ассоциированных с очагом воспаления и предназначенных для локального, но не
системного действия [11, 12, 13, 14, 15].
Учитывая выраженные метаболические нарушения и, исходя из взаимосвязи
структуры и функции, представляет интерес изучение морфологических изменений во
внутренних органах при системном воспалении на модели реперфузионного синдрома.
Материал и методы
Экспериментальные исследования проведены на 40 белых крысах-самцах линии
«Vistar», массой 180-200 грамм. Животные содержались в стандартных идентичных
условиях, что необходимо для создания структурной группы. Экспериментальные
исследования проводились в соответствии с требованиями «Европейской конвенции о
защите позвоночных животных, которые используются в исследовательских и других
научных целях» (Strasburg, 18.03.1986) и постановления Первого национального конгресса по биоэтике (Киев, 2001) [16].
Исследование проводили на модели реперфузионного синдрома. РС моделировали
путем наложения резиновых жгутов на обе задние конечности животных на уровне
паховой складки сроком на 6 часов под легким эфирным наркозом. Ширина пережатия
тканей составляла 2-3 мм. Критерием состоятельности наложения жгута являлось
отсутствие отека конечности и бледность их окраски. Забой животных и забор
биологического материала осуществляли через 6, 12 и 24 часа после
реваскуляризации конечностей, Морфологические изменения исследовали в тканях сердца,
легких, почкек, печени, из которых вырезали фрагменты ткани размерами 1см х 1см
х 1см, предназначенные для гистологического исследования, с последующей
фиксацией в 10 % растворе нейтрального формалина. Минимальный срок фиксации
составлял 10 дней, в течение которых фиксирующая жидкость сменялась дважды.
Фиксатор отмывали в проточной водопроводной воде 24 часа. Ткань обезвоживали в батарее
спиртов восходящей концентрации (50 %, 60 %, 70 %, 80 %, 96 % и абсолютный
спирт), просветляли в ксилоле, выдерживали в насыщенном при +37 ºС
растворе парафина в ксилоле, затем помещали в парафин при +56 ºС, с
последующей заливкой в смесь парафина и пчелиного воска и изготовлением парафиновых
блоков, из которых готовили серийные срезы толщиной 4-5 мкм. С целью обзорной
окраски, гистологические срезы окрашивали гематоксилином и эозином. Для
выявления компонентов соединительной ткани окрашивали пикрофуксином по Ван
Гизону, соединительнотканные волокна окрашивались в красный цвет. Просмотр и цифровые
фотографии микропрепаратов осуществляли с помощью светового микроскопа «Olympus
CX — 41».
Фиксацию материала для электронной микроскопии осуществляли 2,5% раствором
глютаральдегида на фосфатном 1М буфере (рН=7,4) в холодильнике при температуре
+4 °С в течение 1-го часа. Отмывку фиксатора проводили 1М фосфатным буфером (рН
7,4). Затем в течение 1-го часа в холодильнике производили дофиксацию материала
1,3% раствором тетраоксида осмия (OsO4).
Проводка по спиртам восходящей концентрации (этанол) осуществлялась по
следующей схеме: 25% спирт – 5 и 10 минут; 30% спирт – 5 и 10 минут; 50% спирт
– 5 и 10 минут; 70% спирт – 2 часа в холодильнике; 96% спирт – 2 раза по 25
минут; 100% спирт – 2 раза по 25 минут. Затем материал проводили через
абсолютный ацетон 2 раза по 25 минут и помещали в смесь ацетон-смола (1:1) на 1
час с закрытыми пробками, затем на 1 час с открытыми пробками. Заливка
материала в смолы осуществлялась с использованием равных количеств смеси А
(Эпон — 812 — 62мл + ДДСА — 100мл) и смеси Б (Эпон — 812 — 100мл + MNA — 89мл) с добавлением ДМР — 30 из
расчета 0,15мл на каждые 5 мл смеси. Полимеризацию осуществляли в течение 1,5
суток в термостате при t=37°С
на ночь, 45°С – на день, 54°С – на ночь. Полутонкие срезы (1 мкм) изготавливали
на ультратоме «Reichert» и после
окраски метиленовым синим просматривали в световом микроскопе. После этого на
том же ультратоме изготавливали тонкие срезы (30 – 60 нм), которые после
окраски по Рейнольдсу фотографировали и просматривали на электронном микроскопе
«Jem 1010» (JEOL).
Результаты и обсуждение
Результаты гистологического
исследования миокарда указывают на то, что через 12 часов после
реваскуляризации конечностей отмечаются следующие нарушения периферического
кровообращения: полнокровие вен и артерий, сосудов микроциркуляторного русла с
расширением их просветов и истончением стенок; явления стаза и сладжа, при
котором наблюдали агрегацию эритроцитов в виде «монетных столбиков».
Повышенная проницаемость сосудистой стенки проявляется набуханием эндотелия,
гомогенизацией отдельных сегментов и нарушением целостности стенки, а также
накоплением жидкости в интерстициальной ткани с образованием периваскулярного и
межуточного отека (рис. 1). Отмечаются множественные петехиальные
кровоизлияния, проявляющиеся периваскулярными геморрагическими инфильтратами и
локализующиеся диффузно как в субэндокардиальной и субэпикардиаьной области,
так и в толще миокарда.
Наряду с микроциркуляторными
нарушениями значительным изменениям подвергаются и кардиомиоциты. Мышечные
волокна разобщены и имеют извитой ход, местами фрагментированы с очагами
зернисто-глыбчатого распада. Отмечается белковая дистрофия кардиомиоцитов и
интрацеллюлярный отек, цитоплазма их набухшая, поперечность местами
отсутствует.В ядрах клеток происходит уменьшение количества хроматина, что
проявляется резким разрежением центральной части кариоплазмы; лишь небольшое
количество хроматина в виде глыбок гетероформы конденсируется вблизи
кариолеммы.
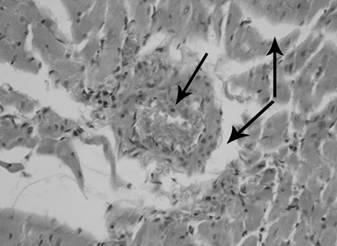
Рис. 1. Миокард крысы при моделировании
реперфузионного синдрома через 12 часов после снятия жгутов. Артериальная
гиперемия, периваскулярный и интерстициальный отек миокарда (стрелки). Окраска
гематоксилином и эозином. Микрофотография. Ув. 400.
Саркоплазма в таких клетках рыхлая,
пониженной электронно-оптической плотности с резко расширенными канальцами
цитоплазматической сети. В наибольшей степени изменениям подвергаются
митохондрии, со стороны большинства из которых отмечаются набухание и
увеличение в размерах, что, как правило, сопровождается нарушением правильности
расположения крист, их разрыхлением, дизориентацией и дискомплексацией.
При гистолологическом исследовании
тканей легких выявляются выраженные морфологические изменения с развитием
признаков синдрома острого легочного повреждения. В альвеолах имеют место
изменения по типу вентиляционно-циркуляторных расстройств. Они представлены
более или менее обширными участками ателектаза и дистелектаза, чередующимися с
участками вздутия легочной ткани. Просветы альвеол резко сужены и представляют
собой узкие щели, в некоторых участках просвет альвеол не определяется. Рядом с
такими зонами наблюдаются очаги резкого вздутия легочной ткани, проявляющиеся
расширением просвета альвеол и истончением межальвеолярных перегородок, вплоть
до их разрыва, обеднением клеточными элементами. Просветы терминальных и
респираторных бронхиол резко расширены. В просветах альвеол – отечная жидкость,
эритроциты, десквамированные альвеолоциты. Отек затрагивает практически все
компоненты аэрогематического барьера. Так, в эндотелиоцитах капилляров
межальвеолярных перегородок он проявляется в резком разрыхлении и разрежении
цитоплазмы, что сопровождается снижением ее электроннооптической плотности. В
цитоплазме появляются сливающиеся между собой микропиноцитозные везикулы, в
результате чего образуются различные по размерам и форме вакуоли. В ядрах,
имеющих, как правило, округлую и/или овальную форму, наблюдается
перераспределение хроматина с его преимущественной локализацией в виде глыбок
вблизи кариолеммы, из-за чего центральная часть ядра просветляется и разрыхляется.
В этих условиях эндотелиальные клетки увеличиваются в размерах, что приводит к
сужению просвета капилляров. Базальные эндотелиальная и эпителиальная мембраны
теряют четкость своих контуров и выглядят разрыхленными, а не гомогенными. Интерстиций расширяется, само
интерстициальное пространство приобретает светлый вид низкой электроннооптической
плотности с разрыхленными обрывками коллагеновых волокон. Среди альвеолоцитов в
наибольшей степени изменяются альвеолоциты I типа. При этом наиболее выраженные их изменения отмечаются в
цитоплазматических отростках. В цитоплазме появляется большое количество
хаотично расположенных микропиноцитозных везикул, многие из которых сливаются
между собой с образованием более или менее крупных вакуолей. Также имеет место
дегрануляция тканевых базофилов, с «запустением» секреторных гранул (рис. 2).
Нарушения микроциркуляции сопровождаются развитием резкого повышения
проницаемости сосудистой стенки с развитием диффузной геморрагической
инфильтрацией в межальвеолярных перегородках и выраженным интерстициальным
отеком.
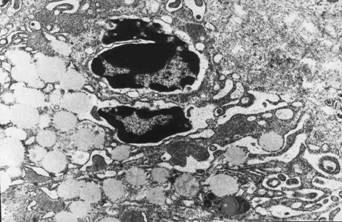
Рис. 2. Легкое
крысы при моделировании реперфузионного синдрома через 12 часов после снятия
жгутов. Дегрануляция базофила с «запустением» секреторных гранул. Электронная
микрофотография. Ув. 8000.
Отмечаются кровоизлияния под висцеральную
плевру. В резко расширенных просветах сосудов выявляется краевое стояние и
агрегация форменных элементов крови, плазматизация содержимого сосудов. В
капиллярах межальвеолярных перегородок и в мелких ветвях легочной артерии
отмечаются явления стаза, сладжа и образование фибриновых тромбов.
Таким образом, морфологическая
картина легких характеризуется гемодинамическими и вентиляционными нарушениями
вплоть до развития синдрома острого легочного повреждения, характерными
признаками которого являются множественные кровоизлияния в паренхиму легких,
стаз, сладж, фибриновые тромбы, очаги ателектаза и дистелектаза, участки
острого вздутия альвеол. При анализе гистологических препаратов почечной ткани
крыс с моделью реперфузионного синдрома также обнаружены выраженные
расстройства кровообращения, дегенеративные и деструктивные процессы, вплоть до
развития некротического нефроза. Через 12 часов после снятия жгутов наблюдали наличие
морфологических признаков «шоковой почки», проявляющиеся наиболее выраженными
нарушениями микроциркуляции. В мозговом слое и юкстамедуллярной зоне отмечалось
резкое расстройство кровообращения, проявляющиеся полнокровием венозных сосудов
с расширением их просвета и истончением стенок. Некоторые сосуды
трансформированы в лакуны с тонкой недифференцированной стенкой и очаговыми
разрывами с образованием периваскулярных петехиальных кровоизлияний. В корковом
веществе, наоборот – спазм артериол и малокровие сосудов, что ведет к ишемии
коркового слоя и тубулонекрозу. Клубочки набухшие, стенки капилляров отечны за
счет фибриноидного набухания, базальная мембрана утолщена. В капиллярах
обнаруживали стаз, сладж и фибриновые тромбы. Отмечается очаговый фибриноидный
некроз стенки капилляров клубочков, очаговая пролиферация мезангиальных и
эндотелиальных клеток.
Большинство проксимальных извитых канальцев набухшие с выраженной
белковой и гидропической дистрофией в результате чего просвет канальцев резко
сужен. В большинстве проксимальных канальцах эпителий десквамирован,
наблюдается некроз нефроцитов, разрывы канальцевых мембран (тубулорексис) и
кариолизис. При этом желчный пигмент пропитывает некротизированные канальцы.
Такие же деструктивные процессы наблюдаются и в дистальных канальцах. Часто
образуются цилиндры в дистальных канальцах и собирательных трубочках; цилиндры
состоят из клеточного детрита и белков (рис. 3).
Гистологические изменения в печени при реперфузионном синдроме
проявлялись выраженным нарушением гемодинамики с признаками нарастающей
венозной гиперемии, спазмом артериол, дискомплексацией балочного строения;
межуточным, межклеточным и периваскулярным отеком.
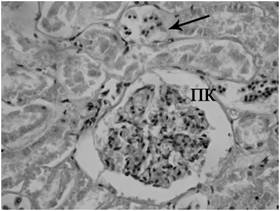
Рис. 3. Почки крысы при моделировании
реперфузионного синдрома через 12 часов после снятия жгутов. Кровоизлияние,
некроз нефроцитов проксимальных канальцев и тубулорексис (отмечено стрелкой).
Окраска гематоксилином и эозином. Микрофотография. Ув. 200.
Ультраструктурные изменения,
возникающие при этом в стенках сосудов и эндотелиальных клетках, не отличаются
от таковых, описанных выше при изучении других органов. Наблюдаются
дистрофические и некробиотические изменения гепатоцитов. Гепатоциты набухшие,
цитоплазма их зернистая. Через 12 часов после реваскуляризации конечностей
наблюдается накопление в гепатоцитах мелких пылевидных или крупнокапельных
прозрачных вакуолей, что характерно для жировой трансформации гепатоцитов. По
периферии долек отмечается некроз гепатоцитов. Также имела место диффузная
геморрагическая инфильтрация стромы. В частности, в некоторых гепатоцитах
происходит гомогенизация матрикса митохондрий с потерей четкости очертаний их
крист, тогда как в других случаях отмечается резкое набухание этих органелл с
просветлением их матрикса. В некоторых гепатоцитах происходит обеднение их
цитоплазмы гранулами гликогена, вокруг многих из них появляются светлые
очертания, что придает им вакуолеподобный вид. Явления интрацеллюлярного отека
выражены в значительно меньшей степени, чем в других органах и, как правило,
затрагивают лишь канальцы цитоплазматической сети.
Анализ вышеописанных результатов
позволяет сделать вывод об универсальности многих признаков морфологической
альтерации отдаленных органов. Среди всех выявленных патоморфологических
изменений условно можно выделить неспецифические, характерные для реперфузионного
синдрома вне зависимости от локализации. Прежде всего, к ним относятся
нарушения микроциркуляции: спазм артериол, венозная гиперемия, явления стаза и
сладжа, микротромбозы; периваскулярный и интерстициальный отек. Перечисленные
признаки характерны для классической патоморфологической картины острого
экссудативного воспаления. Очевидно, что возникновение этих изменений вызвано
генерализацией воздействия медиаторов воспаления, образовавшихся в
ишемизированной ткани и поступивших в системный кровоток после
реваскуляризации. Обобщая изложенное, можно предположить, что синдром системной
воспалительной реакции играет ключевую роль в формировании органопатологии при
экстремальных состояниях.
Выводы
Таким образом, анализ морфологических изменений показал, что при развитии
реперфузионного синдрома морфологическая картина сопровождается системным резко
выраженным нарушением микроциркуляции с развитием дегенеративных и
деструктивных процессов в жизненно важных органах. При этом микроциркуляторные
нарушения при изучаемой патологии носят генерализованный характер. Это дает
основание предполагать, что в патогенезе органопатологии при моделировании
реперфузионного синдрома ведущая роль принадлежит синдрому системной
воспалительной реакции.
Литература
1. Таций Ю.П., Вардосанидзе
С.Л., Вырвыхвост А.В., и др. Метаболические и тканевые соотношения во время
реперфузионного синдрома // Ангиология и
сосудистая хирургия. — 2001. – Т. 7, №4. – С. 44-50.
2. Кашталап В.В., Барбараш О.Л.,
Воронова Н.Л. Влияние системной тромболитической терапии альтеплазой и
стрептокиназой на показатели функции эндотелия и прогноз пациентов с инфарктом
миокарда с подъемом ST // Бюлл. СО РАМН. – 2006. — №4
(126). – С. 132-137.
3.
Bilenko
M.V. Free-radical mechanisms of macrophage involvement in endothelial cell
injury and LDL oxidation in ischemic and reperfused vessels. Abstract From the
XYII ISHR World Congressnof the International Society for Heart Research. July
6-11, Winnipeg, Canada // J. Mol. Cell. Cardiol. 2001. — Vol. 33, № 6. – Р. 13.
4.
Knight
S. Renal functional responses to ischaemia-reperfusion injury in normotensive
and hypertensive rats following non-selective and selective cyclo-oxygenase
inhibition with nitric oxide donation / S.Knight, E.J., Johns // Clin. Exp.
Pharmacol. Physiol. – 2008. — Vol. 35, № 1. – P. 11-16.
5.
Rossi
A. The role of 5-lipoxygenase and leukotrienes in shock and
ischemia-reperfusion injury / A. Rossi, C. Pergola, S. Cuzzocrea et al. //
Scientific World Journal. – 2007. — № 7. – Р. 56-74.
6.
Douvas
S. Anti-Inflammatory and antimicrobial roles of secretory leukocyte protease
inhibitor / S. Douvas, A. Kolokotronis, P. Stefanopoulos // Infection and
Immunity. – 2005. – Vol. 73, №. 3. – P. 1271-1274.
7.
Hayama
T. Benefical
effect of neutrophil elastase inhibitor on renal warm ischemia-reperfusion
injury in the rat / T. Hayama, M. Matsuyama, K. Funao // Transplant Proc. – 2006. – Vol. 38, № 7:2201-2203.
8. Симоненков А.П. О единстве тканевой
гипоксии и шока / А.П. Симоненков, В.Д. Федоров // Анестезиология и
реаниматология. 2000.
— № 6. – С.73-76.
9.
Киричек Л.Т. Молекулярные основы
окислительного стресса и возможности его фармакологической регуляции / Л.Т. Киричек, Е.О. Зубова // Междунар. мед. журнал. – 2004. – Т. 10, № 1. – С. 144-148.
10.
Лущак В.И.
Окислительный стресс и механизмы защиты от него // Биохимия. – 2001. – Т. 66, №
5. – С. 592-609.
11.
Гусев Е.Ю.,
Осипенко А.В. Иммунология системного воспаления. Иммунология Урала. – 2001. — № 1. – С. 4-8.
12.
Черешнев В.А.,
Гусев Е.Ю. Системное воспаление как иммунопатобиологический феномен // Цитокины и воспаление . – 2002. — Т.1, № 2. – С. 17.
13.
Rodrigez
M., Santolaria F., Jarque A. et al. Prognostic value of cytokines in SIRS general medical
patients // Cytokine. – 2001. — № 15. – Р. 232-236.
14.
Naoyuki M., Yuichi H. Systemic Inflammatory Response
Syndrome (SIRS): Molecular
Pathophysiology and Gene Therapy // J. Pharmacol. Sci. — 2006. — № 101. – Р.189 – 198.
15.
Brum-Buisson
C. The epidemiology of the systemic inflammatory response // Intensive Care Med. – 2000. — № 26. – Р. S64–S74.
16.
Європейська
конвенція про захист хребетних тварин, що використовуються для дослідних та
інших наукових цілей / Страсбург, 18 березня 1986 року: Збірка договорів Ради
Європи: Українська версія // Є.М. Вишневський (пер. та ред.). — К.:
Парламентське видавництво, 2000. — 654 с.
РЕЗЮМЕ
Патоморфологические изменения в органах крыс при
моделиРОВАНИИ реперфузионного синдрома
Харченко В. З., Кубышкин А. В., Алиев Л. Л., Фомочкина И. И.
Крымский государственный медицинский университет им. С.И. Георгиевского,
Симферополь.
реперфузионный синдром патология
В эксперименте при моделировании системной воспалительной реакции на
модели реперфузионного синдрома у крыс отмечались выраженные изменения
ультраструктуры внутренних органов. При развитии системной воспалительной
реакции морфологическая картина сопровождается системным резко выраженным
нарушением микроциркуляции с развитием дегенеративных и деструктивных изменений в жизненно важных органах. Следует
отметить, что микроциркуляторные нарушения при изучаемой патологии носят
универсальный характер вне зависимости от локализации. Это дает основание
предполагать ведущую роль синдрома системной воспалительной реакции в
органопатологии.
Ключевые слова: реперфузионный синдром, патоморфологические изменения в
миокарде, легких, почках, печени.
SUMMARY
PATHOMORPHOLOGICAL CHANGES IN ORGANS of rats at model OF REPEFUSION syndrome
Harchenko V. Z, Kubyshkin A. V, Aliev L. L, Fomochkina I. I.
The Crimean State Medical University named after S.I.
Georgyevsky, Simferopol.
In experiment at modelling of reperfusion syndrome at rats
the expressed changes of ultrastructure of internal organs were marked. At
development of systemic inflammatory response syndrome the morphological
picture is accompanied by the system disturbances of microcirculation with
development of degenerative and destructive changes in the vital organs. It is
necessary to notice, that expressed disturbances of microcirculation are
universal without dependence on localization. It may be explained by prominent
role of systemic inflammatory response syndrome in pathology of organs/
Keywords: reperfusion syndrome, morphological changes in a myocardium,
lungs, kidneys, liver.
РЕЗЮМЕ
ПАТОМОРФОЛОГІЧНІ ЗМІНИ В ОРГАНАХ ЩУРІВ ПРИ МОДЕЛЮВАННІ
РЕПЕРФУЗІЙНОГО СИНДРОМУ
Харченко В З., Кубишкін А. В, Алієв Л. Л., Фомочкина І. І.
Кримський державний медичний університет ім. С.І. Георгієевського,
Сімферополь
В експерименті при моделюванні реперфузійного синдрому у
щурів спостерігалися виражені зміни ультраструктури внутрішніх органів. При
розвитку системної запальної реакції морфологічна картина супроводжувалася
системним різко вираженим порушенням мікроциркуляції з розвитком дегенеративних
і деструктивних змін в життєво важливих органах. Слід зазначити, що порушенням
мікроциркуляції мають універсальний характер поза залежністю від локалізації.
Це дає підстави вважати, що синдром системної запальної реакції грає провідну
роль у виникненні органопатології.
Ключові слова: синдром системної запальної реакції,
патоморфологічні зміни в міокарді легенях, нирках, печінці.
