Содержание
Введение
Глава 1. Стероидные гормоны
1.1 Понятие и синтез
1.2 Эфиры стероидных гормонов
1.3 Производные стероидных гормонов
Глава 2. Андрогенные гормоны
2.1 История
2.2 Тестостерон-пропионат
2.3 Тестостерон-энантат
2.4 Метилтестостерон
2.5 Метиландростендиол
2.6 Определение подлинности препаратов андрогенов
Глава 3. Эстрогенные гормоны
3.1 История
3.2 Эстрадиол-монобензоат
3.3 Эстрадиол-дипропионат
3.4 Определение подлинности препаратов эстрогенов
Глава 4. Гестагенные гормоны
4.1 История
4.2 Прогестерон
4.3. Прегнин
4.4 Определение подлинности препаратов гестагенов
Глава 5. Кортикостероидные гормоны
5.1 Характеристика
5.2 Дезоксикортикостерон-ацетат
5.3 Кортизон-ацетат
5.4 Производные и аналоги кортизона
5.5 Гидрокортизон
5.6 Альдостерон
5.7 Преднизон
5.8 Преднизолон
5.9 Дексаметазон
5.10 Определение подлинности препаратов кортикостероидов
Выводы
Список использованной литературы
Введение
Стероидные гормоны — группа физиологически активных веществ (половые гормоны,
кортикостероиды и др.), регулирующих процессы жизнедеятельности у животных и человека.
Стероидные гормоны — один из главных
классов гормональных соединений всех видов позвоночных и многих видов беспозвоночных
животных. Они являются регуляторами фундаментальных процессов жизнедеятельности
многоклеточного организма — координированного роста, дифференцировки, размножения,
адаптации, поведения.
У позвоночных стероидные гормоны
синтезируются из холестерина в коре надпочечников, клетках Лейдига семенников, в
фолликулах и желтом теле яичников, а также в плаценте. Характерная особенность синтеза
стероидных гормонов — ряд последовательно протекающих процессов гидроксилирования
молекул стероидов, происходящих в митохондриях и микросомах.
Стероидные гормоны содержатся
в составе липидных капель в цитоплазме в свободном виде. В связи с высокой липофильностью
стероидные гормоны относительно легко диффундируют через плазматические мембраны
в кровь, а затем проникают в клетки-мишени.
Действие стероидных гормонов на
клетки-мишени осуществляется, главным образом, на уровне регуляции транскрипции
генов. Оно опосредуется образованием комплекса гормона со специфическим регуляторным
белком — рецептором, узнающим определенные участки ДНК в генах, регулируемых данным
гормоном. Таким образом, рецепторы всех стероидных гормонов — лиганд-зависимые факторы
транскрипции. Для них характерно значительное сходство аминокислотных последовательностей,
идентичная доменная структура и сходный механизм действия.
Данные вещества являются очень
важной частью в организме, так как выполняют множество функций. Одной из наиболее
важной функцией, является регуляция периода беременности у женщин, а так же регуляция
углеводного и водно-солевого обмена в организме. У мужчин, благодаря стероидам происходят
такие процессы как; эякуляции и сперматогенез. Данные вещества участвуют во многих
процессах в организме. С каждым годом, в медицине, обнаруживаются функции, за которые
отвечают стероидные гормоны. Многогранность в функциональности этих гормонов объясняется
тем, что это результат взаимодействия данных гормонов со многими различными рецепторами
в организме.
О том, что при помощи стероидных
гормонов можно лечить различного рода недуги поведал всему миру всем известный ученый
Джеймс Райт. Именно он стал первым человеком, который начал изучать воздействие
определенного количества этих препаратов на организм при наличии у человека того
или иного заболевания.
Вследствие своей многофункциональности,
использование их в медицине в качестве средств лечения каких либо заболеваний очень
широко. Они по-разному используются в медицине – в первую очередь, как противовоспалительные
и противозачаточные средства.
К гормонам коркового слоя надпочечников
относятся такие гормоны как кортикостероиды: Гидрокортизон, Кортизон, Кортикостерон,
Преднизолон, Прегнан. К половым гормонам мужчин относятся; Андростерон, Тестостерон,
Метилтестостерон. К женским половым гормонам относятся; Эстрон, Эстрадиол, Эстриол,
Этинилэстрадиол.
В данный момент существует множество
препаратов стероидных гормонов, поэтому анализ их качества является весьма актуальной
проблемой.
Глава 1. Стероидные гормоны
1.1 Понятие и синтез
Cтероидные гормоны — это жирорастворимые
(липидные) гормоны, являющиеся по структуре стероидами, но способные проникать через
клеточную мембрану и избирательно взаимодействуя со специфическими ядерными рецепторами
вызывать изменения в генетическом аппарате клетки, то есть осуществляющие гормональную
регуляцию в организме человека.
Выделяют четыре наиболее общие
группы стероидных гормонов: минералкортикоиды, глюкокортикоиды, андрогены и эстрогены.
Основными представителями этих
каждой из этих групп являются альдостерон, кортизол, тестостерон и эстрадиол соответственно.
Кроме того, выделяют группу прогестагенов,
основным представителем которой является прогестерон.
Дополнительно разделяют стероидные
гормоны из этих пяти групп на две условные группы: половые гормоны (прогестагены,
андрогены и эстрогены) и кортикостероиды (минералкортикоиды и глюкортикоиды).
Синтез различных стероидных
гормонов из холестерина осуществляется последовательными ферментативными реакциями.
Основной путь стероидогенеза, приводящий к образованию минералокортикоидов, глюкокортикоидов,
андрогенов и эстрогенов, представлен на приведенном рисунке. Первая стадия на пути
превращения холестерина в прегненолон является реакцией, которая происходит во всех
стероид-продуцирующих тканях. Эта стадия, лимитирует скорость синтеза стероидных
гормонов. Последующие ферментативные реакции стероидогенеза происходят только в
определенных тканях.
В организме человека не существует
никакого механизма, способствующего накоплению стероидных гормонов в клетках. Только
гормональный предшественник в форме эфиров холестерина накапливается в стероид-продуцирующих
клетках в значительных количествах. Синтезированные же в них стероидные гормоны
быстро попадают через клеточную мембрану в кровяное русло, и, осуществляя свою гормональную
регуляцию, постепенно выводятся из организма (в активной форме стероидные гормоны
имеют относительно малый период полувывода).

Регуляция синтеза стероидных гормонов
осуществляется с помощью пептидных гормонов вырабатываемых гипоталамусом и гипофизом.
Кортикотропин, вырабатываемый гипофизом, стимулирует секрецию кортикостероидов (минералкортикоидов
и глюкокортикоидов). Гонадотропины (фоллитропин и лютеотропин), вырабатываемые передней
долей гипофиза, стимулируют синтез андрогенов и эстрогенов. В свою очередь, гонадолиберин,
вырабатываемый гипотоламусом контролирует синтез и освобождение гипофизных гонадотропинов.
Выработка пептидных гормонов гипоталамусом
и гипофизом зависит от концентрации контролируемых гормонов в крови и регулируется
по принципу обратной связи. Попадание в организм экзогенных стероидных гормонов
со скоростью, превышающей скорость синтеза соответствующих эндогенных стероидных
гормонов, практически полностью подавляет выработку стимулирующих пептидных гормонов,
что приводит к подавлению механизмов синтеза соответствующих эндогенных гормонов,
и в результате нарушается общий гормональный баланс в организме.
1.2 Эфиры стероидных гормонов
Эфир представляет собой цепочку
из атомов углерода, водорода и кислорода, которая присоединяется к молекуле стероида
(обычно на место атома водорода в 17-ой позиции), образуя эфир стероида. Эфиры стероидов
имеют повышенную жирорастворимость и пониженную водорастворимость, в результате
чего они надолго задерживаются в организме и медленней поступают в кровь из места
инъекции.
Стероид с присоединенным к нему
сложным эфиром является неактивным и не способен связываться с рецепторами. Активация
стероида происходит при отщеплении эфира от стероида под действием фермента эстераза
(с восстановлением водорода для формирования гидроксильной группы в 17-ой позиции,
если эфир был присоединен к ней), после чего стероид способен взаимодействовать
с рецепторами. Свойств самого стероида эфир не изменяет — после его отщепления стероид
действует как обычно и выводится из организма со скоростью зависящей от собственного
периода полувывода (полураспада) этого стероида из организма.
Как правило, чем длиннее эфирная
цепочка, тем меньше водорастворимость эфира стероида, он медленнее начинает действовать,
но имеет больший период полураспада. Кроме того, чем тяжелее цепочка, тем больше
ее доля в общем весе эфира стероида, а значит, относительная концентрация самого
стероида ниже.
Таблица 1
Список основных эфиров стероидов
| Название эфира и его период полураспада в организме, в сутках |
Существующие эфиры стероидов | Препараты, в состав которых входит эфир стероида |
|
|
Ацетат (Acetate) Формула:
|
3 | Метенолона Ацетат (Methenolone Acetate) |
Примоболан Primobolan
|
| Стенболона Ацетат(Stenbolone Acetate) |
Анотрофин, Стенболон Anatrofin, Stenbolone
|
||
| Тестос терона Ацетат (Testosterone Acetate) | |||
| Тренболона Ацетат (Trenbolone Acetate, Trembolone Acetate) |
Тренбол, Финаджект, Финаджет, Финапликс Finaject, Finajet, Trenbol | ||
|
Бензонат (Benzonate)
|
6 | Эстрадиола Бензоат(Estradiol Benzonate) | Эстандрон Estandron |
|
Бутират (Butyrate)
|
6 | Тестостерона Бутират (Testosterone Butyrate) |
|
|
Валерат (Valerate)
|
7.5 | Эстрадиола Валерат (Estradiol Valerate) | |
|
Гексагидробензилкарбонат (Hexahydrobenzylcarbonate) Масса:
|
12 | Тренболона Гексагидробензилкарбонат(Trenbolone Hexahydrobenzylcarbonate,Trembolone Hexahydrobenzylcarbonate) |
Параболан Parabolan |
|
Гексаноат (Hexanoate)
|
9 | Тестостерона Гексаноат (Testosterone Hexanoate) | Омнадрен Omnadren |
|
Гексилоксифенилпропионат (Hexyloxyphenylpropionate)
|
12 | Нандролона Гексилоксифенилпропионат (Nandrolone Hexyloxyphenylpropionate) | Анадур |
|
Гептаноат (Heptanoate)
|
10.5 | Тестостерона Гептаноат(Testosterone Heptanoate) | |
|
Гептилат (Heptylate)
|
10 | Тестостерона Гептилат (Testosterone Heptylate) | Тестостерон терамекс Testosterone Teramex |
|
Деканоат (Decanoate) Формула:
|
15 | Тестостерона Деканоат (Testosterone Decanoate) | Сустанон Sustanon |
| Нандролона Деканоат (Nandrolone Decanoate) |
Анаболин, Дека-Дуболин, Дека-Дураболин, Дека-Дурабол, Еболан, Anaboline, Jebolan, Deca-Durabolin, Deca-Durabol, Deca-Durabolin,
|
||
|
Изогексаноат(Isohexanoate)
|
9 | Тестостерона Изогексаноат (Testosterone Isohexanoate) |
Омнадрен Omnadren |
|
Изокапроат (Isocaproate) Формула:
|
9 | Тестостерона Изокапроат (Testosterone Isocaproate) |
Сустанон, Омнадрен (новый), Эстандрон Sustanon, Omnadren,
|
|
Капроат (Caproate) Формула:
|
9 | Тестостерона Капроат(Testosterone Caproate) |
Омнадрен (новый) Omnadren
|
|
Лаурат (Laurate) Формула:
|
17 | Нандролона Лаурат (Nandrolone Laurate) | Лаураболин |
|
Нонаноат (Nonanoate)
|
13.5 | ||
|
Октаноат Octanoate)
|
12 | ||
|
Пропионат (Propionate) Формула:
|
4.5 | Андростенедиола Дипропионат (Androstenediol Di-Propionate) |
Дролбан, Мастабол, Мастерен, Мастерид, Мастизоль, Мастерил, Drolban, Mastabol, Masterid, Masteril, Masteron,
|
|
Дромастанолона Дипропионат (Dromastanolone Di-Propionate) Дростанолона Пропионат (Drostanolone Propionate)
|
|||
| Нандролона Пропионат (Nandrolone Propionate) | |||
| Тестостерона Пропионат (Testosterone Propionate) |
Аговирин, Андролан, Андрофон-Рихт, Вирормон, Нео-Номбреол, Омнадрен, Примотестон Депо, Сустанон, Тестенон, Тестовирон Депо, Тестостерон пропионикум, Тестовирон, Тестопин, Тестэнат, Эстандрон |
||
| Метиландростенедиола Дипропионат(Methylandrostenediol Di-Propionate) |
Аквеоус, Метандриол Acverous, Methandriol
|
||
|
Ундеканоат (Undeconoate) Формула:
|
16.5 |
Тестостерона Ундеканоат Нандролона Ундеканоат (Nandrolone Undeconoat e)
|
Андриол, Вириген, Пантестон, Равзини, Рестандол, Ундестор Динаболон, Психоболон
|
|
Ундесиленат (Undecylenate) Формула:
|
13 | Болденона Ундесиленат (Boldenone Undecylenate) | Болдебал, Болденон, Венобол, Ганабол, Пэйс, Сиболин, Эквипойз Boldebal, Boldenon, Equipoise, Ganabol, Pace, Sybolin, Vebonol |
|
Фенилпропионат (Phenylpropionate) Формула:
|
4.5 | Нандролона Фенилпропионат (Nandrolone Phenylpropionate) | Активин, Анаболин, Андролон, Дубол, Дураболин, Нандроболин, Нероболин, Суперанаболин, Туринабол, Ферболико, Феноболин, Эквиболин, Эстандрон |
| Норетандролона Фенилпропионат (Norethandrolone Phenylpropionate) |
Дурандрон, Омнадрен, Сустанон Durandron,
|
||
| Тестостерона Фенилпоропионат (Testosterone Phenylpropionate) |
|||
| Эстрадиола Фенилпропионат (Estradiol Phenylpropionate) | Эстандрон Estandron | ||
|
Формиат (Formiate, Formate)
|
1.5 | Тестостерона Формиат (Testosterone Formiate, Testosterone Formate) |
Андроцип, Андронад, Деп Андро, Д-Тест, Деп-Тест, Деп-Тестостерон, Депотест, Дуратест, Малоджек Сип, Теста-С, Тестацип, Тестекс Лео пролонгатум, Тестодиета-Депо, Тестоджект, Тестред Ципионат, |
|
Ципионат (Cypionate) Формула:
|
12 |
Тестостерона Ципионат (Testosterone Cypionate) Оксаболона Ципионат(Oxabolone Cypionate) Эстрадиола Ципионат(Estradiol Cypionate)
|
|
|
Стеранабол Депо, Стерон Steranabol Depo, Steranabol Depot, Steranabol
|
|||
|
Энантат (Enanthate) Формула:
|
10.5 | Метенолона Энантат (Methenolone Enanthate) | Примоболан Депо Primobolan Depot |
| Тестостерона Энантат (Testosterone Enanthate) |
Андротардия, Депо-тестостерон, Дура-Тестостерон, Примотестон Депо, Тестостерон Депо, Тестен, Тестостерона Пролонгат, Тестостовирон Депо, Тесто-Энант, Эпармон-Депот, Тестостерон Энантат |
||
1.3 Производные стероидных гормонов
Производные стероидных гормонов
получают путем структурных изменений в молекуле взятого за основу стероида. Таким
образом, получают стероиды имеющие высокую степень сродства с взятым за основу стероидом,
но с измененными в нужную сторону параметрами.
Алкилированием (алькилированием)
называется введение в молекулы соединений алкила, например, метила CH3 (метилирование)
или этила C2H5 (этилирование). Большинство оральных стероидов алкилированы по 17-альфа:
к 17-ой позиции молекулы присоединена метиловая группа (СН3), что предохраняет стероид
от быстрого разрушения в печени (при этом оказывая токсичное действие на нее), увеличивая
период полураспада стероида до нескольких часов.
В зависимости от характера биологической
активности производные стероидных гормонов разделяют на три группы: кортикоидные
(кортикостероиды), анаболические андрогенные (анаболические андрогенные стероиды,
ААC, АС) и эстрогенные стероидные гормоны. Однако в организме, многие производные
стероидных гормонов подвережены ферментативным реакциям в стероид-продуцирующих
тканях, и могут превращаться в другие стероидные гормоны, являясь в этом случае
одновременно и прогормонами (прекурсорами).
Различные производные стероидных
гормонов могут применяться перорально (в виде таблеток или капсул), в виде внутримышечных
инъекций, а также в виде мазей (кремов или гелей) и ингаляционно (в виде спреев).
Глава 2. Андрогенные гормоны
2.1 История
Еще в 1849 г. Бертольдом было
установлено, что у петухов при кастрации наступает атрофия гребня и что, наоборот,
при пересадке семенников молодым кастрированным петушкам у них восстанавливаются
вторичные половые признаки, т. е. рост гребешка, голос, поведение. Отсюда был сделан
вывод, что в семенниках птиц содержатся какие-то активные вещества, обусловливающие
половые отличия и половую деятельность. Кох и Мур и другие авторы приготовили первые
активные андрогенные экстракты, для определения активности которых предлагались
различные методы. В 1927 г. было обнаружено, что активное начало андрогенов содержится
не только в семенниках, но и в моче мужчин. По Вальтеру и Пецарду, тест петушиного
гребня основан на регенерации утраченных у каплунов характерных признаков. По Галахеру
и Коху, петушиной, или каплуньей единицей называется то количество вещества, которое,
спустя 5 дней при ежедневном инъекционном введении масляного раствора, увеличивает
длину гребня на 5 мм. Единицей действия также считают то наименьшее количество
вещества, которое вызывает рост гребня на 15—20% («петушиная единица»). Леве и Восс
предложили и другой тест, основанный на росте семенных пузырьков у кастрированных
грызунов. Дегенерированные после кастрации пузырьки вновь вырастают
при инъекции гормона и, таким образом, секреторная деятельность
восстанавливается.
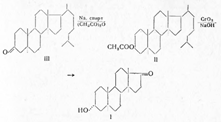
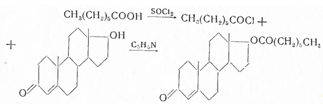
Первым андрогенным гормоном, выделенным
Бутенандтом и Чернингом в 1931 г. из мужской мочи, был андростерон. Он оказался
оксикетоном. Вскоре Бутенандту, Данненбауму и другим авторам удалось выделить еще
один активный непредельный кетон состава С19Н28О2.
Из 5 мг мочи Бутенандту удалось выделить 15 мг мужского гормона. На основании данных анализа, наличия окси- и кетогрупп, а также предположения о генетической
связи гормона, названного андростероном (I), с холестерином ему было установлено
строение андростанол-З-она — 17 (I). В 1934 г. Ружичка подтвердил это строение синтезом
и определил его пространственную конфигурацию, получив ацетат андростерона, окислением
3α-ацетата холестанола (II), в свою очередь полученного из холестанона (III):
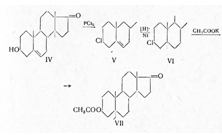
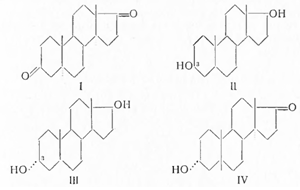
В дальнейшем Бутенандтом был предложен
более эффективный метод получения андростерона из дегидроэпиандростерона (IV). Взаимодействием
последнего с пятихлористым фосфором был получен 3-хлоркетон (V), который после гидрирования
(VI) и обменной реакции с ацетатом калия превращался в ацетат андростерона (VII):
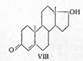
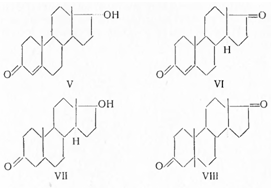
Несмотря на доступность андростерона,
он почти не нашел практического применения, так как в 1935 г. Лакером (Нидерланды)
было показано, что в семенниках быков (и других животных) содержится более активный
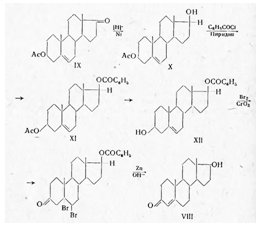
мужской гормон, названный тестостероном (VIII):
Тестостерон активнее андростерона
в 7 раз. Первый синтез тестостерона был осуществлен также Бутенандтом. При гидрировании
ацетата дегидро- эпиандростерона (IX) водородом в присутствии скелетного никелевого
катализатора был получен 3-ацетат-Δ5-андростендиола — 3β,17β
(Х), который бензоилированием в присутствии пиридина превращен в 3β-ацетат — 17-бензоат-Δ5-андростендиола
(XI), а затем частичным гидролизом ацетильной группы при температуре не выше 11°
в 17-бензоат-Δ5-андростендиол-Зβ, 17β (ХII).
Окислением хромовым ангидридом,
в присутствии уксусной кислоты (XI), после предварительной защиты двойной связи
бромированием и последующего дебромирования цинком получен в результате гидролиза
тестостерон (VIII):
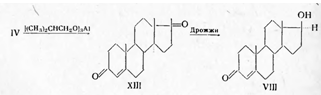
В литературе описан ряд вариантов
синтеза тестостерона из дегидроэпиандростерона (IV), андростендиона (XIII) и другого
исходного сырья. По методу Мамоли, дегидроэпиандростерон (IV) окисляют по
Оппенауэру в андростендион (XIII), который под влиянием дрожжевых грибков восстанавливают
до тестостерона:
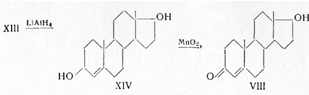
При использовании в качестве исходного
продукта андростендиона его восстанавливают литий-алюминий-гидридом до андростендиола
и затем окисляют перекисью марганца в нейтральном растворе. Этот реагент окисляет селективно лишь аллильные
спирты, в результате чего образуется тестостерон (VIII):
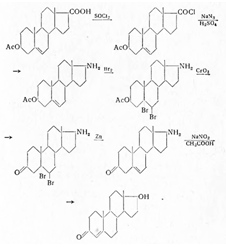
В качестве исходного сырья для
синтеза тестостерона использована также Δ5 — 3-оксиэтиохоленовая кислота.
С помощью хлористого тионила 3-ацетат
ее превращается в хлорангидрид 3-ацетоксиэтиохоленовой кислоты, затем азидом натрия
(в сухом толуоле) и обработкой 60%-ной серной кислотой — в амин. После защиты двойной
связи бромированием гидроксильная группа при С3 окисляется хромовой кислотой,
бром отщепляется цинком и с помощью диазотирования нитритом натрия и разложения
неустойчивого диазосоединения, в присутствии уксусной кислоты, он превращается в
тестостерон:
Тестостерон — мелкий белый кристаллический
порошок, т. пл. 166— 171° не растворим в воде, растворяется в спирте, эфире, хлороформе.
Применяют обычно в виде сложных эфиров — пропионата или энантата.
При синтезе стероидных гормонов
большое значение имеет доступность исходного сырья; в этом отношении β-ситостерин,
получаемый из отходов производства бумаги, является весьма перспективным.
Как показали исследования Д.М.
Халецкого с сотр., технология производства стероидных гормонов из β-ситостерина
мало отличается от их производства из холестерина. Между тем, холестерин является
дорогим сырьем животного происхождения, в то время как β-ситостерин — недефицитным и дешевым.
Тестостерон и его полусинтетические
аналоги обладают способностью оказывать стимулирующее действие на синтез белков
в организме (анаболический эффект). Анаболическое действие проявляют тестостерон,
его эфиры, метилтестостерон. Однако у них этот эффект намного менее выражен, чем андрогенная
активность. Метандриол (метиландростендиол), являющийся промежуточным продуктом
синтеза метилтестостерона, проявляет слабую андрогенную и относительно более высокую
анаболическую активность. Еще более избирательным анаболическим действием обладает
метандиенон (метандростенолон).
Впервые Мишером, Ветштейном и
Шоппом было найдено, что андрогенное действие тестостерона усиливается жирными кислотами
(1936 г.); аналогичное действие наблюдается и в присутствии высших спиртов, например
стеарилового спирта. Дальнейшие исследования показали, что действие тестостерона
повышается также при его этерификации. В связи с этим Ружичка и Ветштейном были
синтезированы эфиры муравьиной, уксусной, пропионовой, масляной и изомасляной кислот,
а также пальмитиновой и стеариновой; оказалось, что первые три эфира проявляют активность
(на петушином гребне) уже в дозах 20 вторые два — в дозах 60—70γ, а
последние два в дозах 1000γ. Слабее действуют ароматические эфиры, например
бензойной кислоты — 100γ. На основании этих данных в медицину был введен тестостерон-пропионат.
2.2 Тестостерон-пропионат
Testosteronum рropionicum. Testosteroni propionas. Тестостерон-пропионат. Δ4-андростен — 3-он — 17
(р)-ол — 17-пропионат. С22Н32О3. М = 314,50
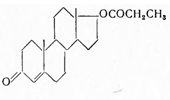
Синонимы: Homosteron, Perandren, Testoviron и др. Получают
нагреванием тестостерона с пропионовым ангидридом при 110—114°, с последующей перекристаллизацией
из метилового спирта:
Тестостерон-пропионат — белый
или белый с кремовым оттенком кристаллический порошок, т. пл. 158—123°, нерастворим
в воде, растворяется в спирте, эфире, растительных маслах; удельный показатель поглощения
при длине волны 241 ммк не ниже 465 (с = 0,001, 95% спирт). При гидролизе
препарата 1%-ным спиртовым раствором едкого кали и последующей нейтрализации соляной
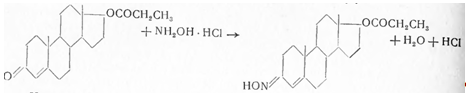
кислотой выделяют тестостерон с т. пл. 150—153°. При нагревании со спиртовым раствором
хлоргидрата гидроксиламина, в присутствии ацетата натрия, выделяют оксим тестостерон-пропионата
с т. пл. 166—171°:
Чистоту препарата определяют по
отсутствию потери в весе при высушивании и прокаливании.
Хранят с предосторожностью (список
Б), в хорошо закупоренных банках, в сухом месте, защищенном от действия света. Высшая
разовая и суточная дозы — 0,05 г. Применяется при половом недоразвитии, мужском
климактерии, нервных расстройствах по 0,025 г; у женщин — при нервных расстройствах,
опухолях молочной железы, маточных кровотечениях и др. по 0,005—0,01 г.
Выпускают в виде 1,2,5 и 5%-ного
раствора в масле (в ампулах).
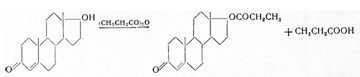
2.3 Тестостерон-энантат
Testosteronum aenanticum. Тестостерон-энантат. Δ4-андростен — 3-он — 17-ол — 17-энантат.
С20Н40О3. М = 400,6
Получают по схеме:
Энантовую кислоту, т. кип. 116—118°,
при 14 мм рт. ст. с помощью хлористого тионила превращают в хлорангидрид, т. кип.
65—66° при 14 мм рт. ст. и последний взаимодействием с тестостероном (в сухом пиридине
и бензоле) при 50—55° в тестостерон-энантат. Для удаления избытка хлорангидрида
энантовой кислоты смесь перемешивают с диэтиламиноэтанолом и выливают в раствор
разбавленной соляной кислоты. После отгонки бензола получают энантат тестостерона,
т. пл. 36—37,5°, удельное поглощение 390. При гидролизе спиртовым раствором едкого
кали, с последующей очисткой ацетоном, температура плавления выделенного тестостерона
151—153°. Чистоту препарата определяют по отсутствию сульфатной золы и энантовой
кислоты. Примесь последней определяют алкалиметрическим титрованием в спиртовой
среде в присутствии индикатора фенолфталеина (содержание ее не должно превышать
0,15%).
Хранят с предосторожностью (список
Б)
Применяют для тех же целей, что
и тестостерон-пропионат; обладает более сильным и более длительным андрогенным действием.
Вводят внутримышечно в виде 5%-ного масляного раствора по 1 мл.
Физиологическое действие андрогенов
зависит от характера кислородных заместителей, но еще в большей степени от их пространственной
конфигурации и характера сочленения колец в молекуле. Так, андростандион — 3,17 (I) обладает
активностью 130γ, почти равной активности андростерона, а андростандиол — 3α,
17ß (II) — активностью в 20—25γ. С другой стороны, эпиандростерон
(III) в 5—6 раз менее активен, чем андростерон, а изомер последнего
— тестанол — 3-он — 17 (IV) с цис-сочленением колец А и В вообще неактивен:
Аналогично 17-изотестостерон (V)
в 20 раз слабее тестостерона, а Δ4-андростендион (VI) слабее его
лишь в 5—6 раз. Дигидротестостерон (VII) не отличается по силе действия от тестостерона,
а 5-эпимер андростандиона — 3,17 (VIII) с цис-сочленением колец А и В неактивен:
Высокую андрогенную активность
обнаруживают дитестостерон-янтарный и глутаровый эфиры (1949), а также гликозиды
и ацетали тестостерона. Полученный из тестостерон-пропионата и пропандиола — 1,3 в
присутствии толуол сульфокислоты тестостерон-пропионат пропандиол-(Г,3′) ацеталь
обнаружил пролонгированное действие; в дозах 100у он действует 22 дня на петушиный
гребень, в то время как тестостерон 15 дней. Как показали Ружичка и Кэги (1937 г.),
17-р-тестостерон в 15—25 раз менее активен, чем его 17-а-изомер; исключение представляет
Дб-андростен — 3-а — 17-Рдиол, который лишь в 5 раз менее активен, чем его
транс-аналог.
2.4 Метилтестостерон
Меlтеsтosтеrоnum. Метилтестостерон.
17-α-метилтестостерон. 17-α-метил –Δ4-андростен — 3-он — 17-ол. С20Н30О2.
М = 302,4

Синонимы: Androral, Oraviron, Testoral и др.
Получают действием магнийбромметила
на 3-ацетатдегидроэпиандростерона — 17 в эфире, с последующим окислением образовавшегося
17-метиландростендиола — 3,17 по Оппенауэру (циклогексаноном в присутствии изобутилата
алюминия и толуола):

17-Метилтестостерон — белый или
белый с кремовым оттенком кристаллический порошок, т. пл. 161—167°, без запаха,
не растворим в воде, растворяется в спирте, эфире, ацетоне, мало растворим в растительных
маслах. Удельный показатель поглощения от 520 до 540 (с = 0,001, 95%-ный
спирт) при длине волны 240 ммк. На воздухе слегка гигроскопичен. При ацетилировании
уксусным ангидридом в присутствии пиридина, образует 17-ацетат — 17α-метилтестостерона
т. пл. 173-176°.
При оксимировании гидрохлоридом
гидроксиламина, в присутствии ацетата натрия в среде метилового спирта, образует
3-оксим 17-метилтестостерона, т. пл. 210—216°.
Чистоту препарата определяют по
потере в весе (не более 1,5%) при высушивании до постоянного веса при 100—105° и
отсутствии сульфатной золы (не более 0,1%).
Хранят с предосторожностью (список
Б), в хорошо закупоренных банках, защищенных от действия света.
Высшая разовая доза — 0,05 г,
суточная — 0,1 г.
Применяют при половом недоразвитии
и функциональных нарушениях половой сферы, а также при маточных кровотечениях в
предклимактерическом и климактерическом периодах. Для большего эффекта действия
рекомендуют сублингвальное применение; таблетку метилтестостерона задерживают под
языком до полного рассасывания.
Выпускают в таблетках по 0,005
г.
2.5 Метиландростендиол
Methylandrostendiolum.
Methandriolum. Метиландростендиол. 17-α-метил-Δ5-андростен — 3β — 17β-диол.
С20Н32О2. М = 304,48.

Синонимы: Androdiol, Metandiol, Notandron, Testodiol
и др.
Является промежуточным продуктом
при синтезе 17-метилтестостерона. 17-Метиландростендиол — белый кристаллический
порошок. Не растворим в воде и мало в спирте, растворяется в хлороформе, пиридине
и кипящем метиловом спирте, т. пл. 202—206°. Раствор препарата в 80%-ной уксусной
кислоте в присутствии концентрированной серной кислоты дает на границе слоев оранжевую
полосу и затем зеленовато-желтую флуоресценцию. При ацетилировании уксусным ангидридом,
в присутствии пиридина, образуется ацетильное производное, т. пл. 133—136°.
Чистоту препарата определяют по
отсутствию кетостероидов (0,002 г препарата растворяют в 1 мл 95%-ногоспирта
и прибавляют 1 мл 95%-ного раствора м-динитробензола и 1 мл 15%-ного
раствора едкого натра — спустя 1 ч раствор не должен быть темнее смеси 1
мл 95%-ного спирта с теми же реактивами).
Хранят с предосторожностью (список
Б), в сухом месте, защищенном от действия света. Применяют сублингвально для усиления
белкового анаболизма у реконвалесцентов после тяжелых травм, операций, инфекционных
и других заболеваний по 0,025—0,05 г на прием в виде таблеток. Обладая значительно
меньшей андрогенной активностью, нежели метилтестостерон, препарат может применяться
и в женской практике с целью повышения анаболизма, а также для уменьшения активности
фолликулярного гормона в климактерическом периоде (и при раке молочной железы).
При длительном применении иногда
наблюдается усиленный рост волос на лице и туловище и увеличение сальности кожи.
Кувада и Мнгасака (1938) синтезировали
различные эфиры 17-метилтестостерона, но не получили интересных для медицины препаратов.
Недеятельным оказался 17-аллилтестостерон, синтезированный Бутенандтом и Петерсом
(1938 г.).
При окислении Δ4-двойной
связи тестостерона перекисью водорода получено соединение строения:

не обладающее андрогенной активностью.
Аналогичны и другие полиоксисоединения, как андростантриол — 3,5,6-он — 17, андростантрион — 3,16,17-ол — 5,
Δ5-андростентрион — 3,4,17 и андростантриол — 3,14,17 — оказались неактивными.
Напротив, андростентрион — 3,6,17 и 6-оксотестостерон в опытах на кастрированных крысах
(самках) вызывали течку, т. е. проявляли активность женского гормона. 3-Галогенопроизводные
дегидроэпиандростерона неактивны, но 17-хлор-Δ5-андростенол — 3-ацетат
достаточно активен (Вестфаль); слабой биологической активностью обладают 17-аминопроизводные
андростана.

Замена пятичленного кольца D на шестичленное приводит к незначительному
уменьшению активнрсти D-гомотестостерона (20—30γ). Он получен из циангидрина
дегидроэпиандростерона (I), который при восстановлении дает оксиамин (II), а при
действии на него азотистой кислоты перегруппировывается по Демьянову с расширением
кольца в D-гомоаналог дегИдроэпиандростерона
(III) и по методу Мамоли переводится в D-гомо- тестостерон
(IV):

Полученный из Зα-окси-D-гомоандростерона
4,5-гомодигидротестостерон действует в опытах на крысах аналогично дигидротестостерону.
Для проявления андрогенной активности
необязательно присутствие С19-метильной группы; 19-нортестостерон также
обладает андрогенной активностью. Он получается из эстрона (V) через метиловый эфир
эстрадиола, с последующим восстановлением ароматического кольца литием и спиртом
в жидком аммиаке в метоксикарбинол (VI); последний при кислотном гидролизе переходит
в 19-нортестостерон (VII):

2.6 Определение подлинности препаратов андрогенов
Наиболее достоверно подлинность
лекарственных веществ можно подтвердить рекомендуемым ФС и МФ методом ИК-спектроскопии.
ИК-спектр испытуемого вещества, снятый в вазелиновом масле в области 3700-400 см — 1,
должен иметь полное совпадение с полосами поглощения спектра ГСО или прилагаемого
к ФС рисунка спектра.
Для испытания подлинности используют
реакции образования сложных эфиров и других производных указанных веществ, которые
имеют стабильную температуру плавления. Так, при действии уксусным ангидридом получают
моноацетаты метилтестостерона (т. пл. 173-176°С) и метандриола (т. пл. 174-180°С):

Тестостерона пропионат и метилтестостерон,
содержашие в положении 3 кетонную группировку, при действии гидроксиламином образуют
оксимы с температурой плавления соответственно 166-171°С и 210-216°С.
Оксим метилтестостерона образуется по схеме:

Метандиенон идентифицируют
по образованию гидразона (окрашенного в оранжево-красный цвет) при взаимодействии
с 2,4-динитрофенилгидразином: Аналогичную цветную реакцию дает тестостерона пропионат
с изониазидом (гидразидом изоникотиновой кислоты). Образуется окрашенный
в желтый цвет изоникотиноилгидразон. Реакцию используют для фотоколориметрического
определения лекарственных форм тестостерона пропионата.

Тестостерона пропионат можно идентифицировать
по сложноэфирной группировке, используя реакцию омыления с последующей проверкой
температуры плавления выделяющегося тестостерона (150-156°С):

Можно применить также реакцию
образования окрашенной комплексной соли железа (III) и пропионогидроксамовой кислоты:

С помощью этой реакции можно отличить
тестостерона пропионат от лекарственных веществ, не являющихся эфирами.
Для испытания на подлинность применяют
(ФС) цветную реакцию на стероидные соединения с концентрированной серной кислотой.
Метилтестостерон и мегандриол образуют при этом желто-оранжевое окрашивание с характерной
зеленой флуоресценцией, а метандиенон — красное окрашивание. Подлинность тестостерона
пропионата и метилтестостерона по МФ устанавливают с помощью ТСХ на адсорбенте кизельгур
Р — 1, в качестве проявителя используют раствор 4-толу- олсульфоновой кислоты в этаноле.
Метод ТСХ рекомендован ФС для испытания подлинности тестостерона пропионата путем
сравнения с ГСО. В тех же условиях определяют примеси посторонних стероидов в четырех
указанных лекарственных веществах. Испытание выполняют на пластинках «Силуфол УФ — 254»,
используя растворы анализируемых и стандартных образцов веществ-свидетелей (или
ГСО) в хлороформе. Хроматограммы после высушивания просматривают в УФ-свете при
254 нм. Наличие допустимых количеств примесей (не более 1%) оценивают по совокупности
величин и интенсивности пятен испытуемого лекарственного вещества и свидетеля. В
метандиеноне устанавливают наличие примеси селена (не более 0,01%) методом сжигания
в кислороде с последующей спектрофотометрией продукта взаимодействия селена с 3,3-диаминобензидина
тетрагидрохлоридом в толуольном извлечении при длине волны 413 нм.
Метод УФ-спектрофотометрии ФС
и МФ рекомендуют для испытания подлинности и количественного определения андрогенных
и анаболических лекарственных веществ. Растворы в этаноле имеют максимумы поглощения
у тестостерона пропионата при длине волны 240 нм, метилтестостерона — при 241 нм,
метандиенона — при 245 нм. В метандриоле определяют светопоглощающие примеси, измеряя
оптическую плотность (не более 0,5) 0,5%-ного раствора испытуемого вещества в этаноле
при длине волны 240 нм. В соответствии с требованиями ФС в максимумах поглощения
выполняют спектрофотометрическое определение указанных лекарственных веществ, используя
растворитель этанол, который служит также раствором сравнения. Расчет содержания
выполняют по удельному показателю поглощения (метилтестостерон — 540; метандиенон — 516) или по ГСО (тестостерона пропионат).
Метандриол количественно определяют
(по ФС) поляриметрическим методом. Измеряют величину угла вращения спиртового раствора
навески и рассчитывают содержание метандриола по величине удельного вращения.
Для надежной идентификации
андрогенных и анаболических стероидов были использованы Н-ЯМР и масс-спектры. Выявлены
химические сдвиги стандартных синглетных сигналов протонов С — 18 и С — 19, а также
основные и характеристические ионы масс-спектров, полученных методом электронного
удара. Для количественного определения применен также метод ВЭЖХ (Э.С. Матыев, А.П.
Арзамасцев).
Андрогенные и анаболические стероидные
лекарственные вещества хранят по списку Б, в хорошо укупоренной таре, предохраняя
от действия света и влаги, под влиянием которых они могут постепенно разлагаться.
Тестостерона пропионат применяют
как андрогенное лекарственное средство при климактерических, сосудистых и нервных
расстройствах, а также для лечения рака молочной железы и яичников у женщин. Назначают
его в виде 1%-ных или 5%-ных масляных растворов подкожно и внутримышечно. Метилтестостерон обладает аналогичным, но в 2-3 раза менее активным андрогенным
действием. Он эффективен при приеме внутрь и подъязычном применении. Выпускают метилтестостерон в таблетках по 0,005 и 0,01 г. Метандиенон и метандриол
обладают анаболическим действием, назначают их при нарушениях белкового обмена вследствие
тяжелых травм, при коронарной недостаточности, язвенной болезни, инфаркте миокарда
и т. д. Выпускают таблетки метандиенона по 0,005 г и метандриола по 0,25 г.
Глава 3. Эстрогенные гормоны
3.1 История
Эстрогенные или женские половые
гормоны выделяются яичниками. В последних секретируются два типа гормонов: фолликулярные,
или эстрогенные, вырабатываемые клетками созревающего фолликула и прогестенальный
гормон (прогестерон), секретируемый клетками желтого тела, образующегося на месте
разорвавшегося фолликула. Эстрогенные гормоны обеспечивают развитие женских половых
органов, вызывают периодическое наступление овуляции, разрастание слизистой оболочки
матки, подготовку ее к воспринятию яйца и развитию плода. Эстрогенные гормоны вызывают
также развитие вторичных женских половых признаков. У животных эстрогенные гормоны
вызывают течку. Течка вызывается также введением кастрированным животным (мышам)
экстрактов яичника, и на этом явлении основан важнейший метод испытания активности
женских половых гормонов, разработанный Алленом и Дойзи (1923 г.). У мышей и крыс
отдельные стадии полового цикла распознаются при рассматривании под микроскопом
мазка, взятого из влагалища, содержащего ороговевшие эпителиальные клетки. По методике
авторов, исследуемое вещество растворяют в масле и вводят подкожно тремя порциями
в течение 24 ч. Одной мышиной единицей (ME) называют наименьшее
количество вещества, которое у 70% мышей вызывает явления эструса. По международному
соглашению 1939 г. для стандартизации женских гормонов используется кристаллический
препарат, под названием эстрон, 0,1γ которого представляет собой 1 международную
единицу (1 ME) эстрогенной активности. Чувствительность метода позволяет
определить 0,1γ эстрона; чувствительность повышается при интравагинальном введении.
Выделение женского гормона долгое
время представляло большие трудности, так как экстракты из яичников, наряду с гормонами,
содержат большое количество примесей. Более пригодный источник эстрогенных гормонов
был найден Цондеком в 1927 г., когда было установлено, что эстрогены содержатся
в значительном количестве в моче беременных женщин. Исследованиями Бутенандта с
сотр. (1939) и Онесона с сотр. (1952) найдено, что в моче беременных эстрон содержится
в виде сульфата (I) и частично в виде глюкоронида (II):

Получение эстрона Бутенандтом
проводилось путем гидролиза мочи соляной кислотой и последующего извлечения гормона
эфиром. После нейтрализации эфирного экстракта раствором гидрокарбоната натрия экстракт
упаривался и экстрагировался толуолом. Из толуола гормоны извлекались 0,1 н. раствором
едкого натра. Из 2 т мочи было выделено около 25 мг эстрона.
В дальнейшем, когда было найдено,
что женские гормоны в значительно больших количествах содержатся в моче жеребых
кобылиц и в моче жеребцов или меринов, были разработаны производственные методы
получения эстрона.
По методу М.Н. Лапинера (1936)
гидролизованная моча жеребых кобылиц извлекается хлороформом и после отгонки растворителя
остаток распределяется между эфиром и раствором щелочи; кристаллизацией из спирта
получают эстрон с примесью эквилина (III) и эквиленина (IV):

При очистке большую помощь оказали
реактивы Жирара Т и Р:

которые благодаря превращению
гормона в растворимое соединение способствовали его изолированию. При последующем
подкислении соляной кислотой выделялся кетон, который экстрагировался подходящим
растворителем. Таким образом, Бутенандтом были выделены из мочи эстрадиол (V) и
эстриол (VI). При нагревании эстриола с бисульфатом калия был выделен эстрон, чем
подтверждено строение последнего; так как эстриол содержит три гидроксильные группы,
то, следовательно, две из них расположены рядом. При сплавлении эстриола с едким
кали получена дикарбоновая кислота (VII), которая при нагревании дала ангидрид (VIII),
а не кетон, что указывало на наличие в молекуле эстриола (и, следовательно, эстрона)
пятичленного кольца:

При нагревании кислоты (VII) с
селеном был выделен 1,2-диметилфенантрол — 7 (VIIIa), строение которого
было подтверждено синтезом:

ространственное строение эстрона
было доказано синтезом из дегидроэпиандростерона (IX) эстрадиола (XV) (Ингоффен)
по схеме:

Важным доказательством в этой
схеме строения эстрадиола явилось бромирование (XII) и получение дибромпроизводного
(XIII), оказавшегося транс-кетоном. Транс-кетоны такого типа в отличие от цис-изомеров
бромируются в положении 2 и 4, а цис-кетоны только в положении 4.
Образование других продуктов (X,
XI, XII, XIV и XV) ясно из схемы.
Эстрогенные гормоны присущи животным
организмам, но они найдены и в растениях, например эстрон, в вытяжке из кокосовых
орехов и в женских цветках ивы.
Вначале, когда химия стероидных
эстрогенов была недостаточно развита, применялись различные препараты: фолликулин
— водный раствор, получаемый из очищенных экстрактов мочи жеребцов, беременных женщин
и др., консервированный трикрезолом, масляный раствор фолликулина (Folliculinum oleosum), приготовленный из кристаллических препаратов смеси эстрона
и его дигидропроизводного; масляный раствор эстрона, содержащий в 1 мл 0,5—1
мг кристаллического гормона, масляный раствор эстрона, содержащий в 1 мл
0,5—1 мг кристаллического гормона, масляный раствор бензоата фолликулина
(Folliculinum benzoatum s. Solutio Folliculim benzoati oleosa).
В настоящее время эти препараты
отсутствуют в ГФ и используются лишь более эффективные, к которым принадлежат эстрадиол-монобензоат
и эстрадиол-дипропионат, применяемые в виде масляных растворов.
3.2 Эстрадиол-монобензоат

Estradiolum monobenzoicum. Эстрадиол-монобензоат.
3-монобензойный эфир β-эстрадиола. С25Н23О3.
М = 376,5.
Получают бензоилированием эстрадиола
хлористым бензоилом по схеме:

Продукт реакции промывают раствором
едкого натра и перекристаллизовывают из спирта.
Эстрадиол-монобензоат
— белый или желтоватый кристаллический порошок, без запаха, т. к. 191—196°, легко
растворим в спирте и ацетоне, малорастворим в растительных маслах, не растворим
в воде. Концентрированной серной кислотой окрашивается в зеленовато-желтый цвет
с голубой флуоресценцией; при добавлении воды окраска переходит в бледножелтую.
Чистоту препарата определяют по отсутствию эстрона (спиртовой раствор при нагревании
со спиртовым раствором м-динитробензола и последующем действии едкого кали не должен
окрашиваться в красный цвет).
Количественное определение препарата
производят биологическим путем. 1 мг его должен содержать 10000ЕД (допускается отклонение
от указанной активности ±25°о). Хранят с предосторожностью (список Б), в хорошо
закупоренных склянках, в сухом месте, защищенном от действия света.
Эстрадиол является естественным
гормоном, так как образуется в организме женщины вместе с эстроном. Являясь эфиром
эстрадиола, он медленно всасывается и обладает пролонгированным действием.
Выпускают в ампулах по
1 мл 0,1%-ного раствора в масле для внутримышечного введения.
3.3 Эстрадиол-дипропионат
Estradiolum dipropionicum. Эстрадиол-дипропионат.
Эфир эстрадиола и пропионовой кислоты. С23Н31О4.
М = 371,25.

Синонимы: Progynon, Synformon и др.
Получают этерификацией эстрадиола
пропионовым ангидридом или хлорангидридом пропионовой кислоты:

Эстрадиол-дипропионат — белый
кристаллический порошок, не растворим в воде, растворяется в спирте, эфире, растительных
маслах. При щелочном гидролизе образует эстрадиол, т. пл. 191—196°, и дает все реакции,
характерные для последнего. Чистоту препарата и количественное содержание его определяют
аналогично эстрадиол-бензоату.
Препарат обладает замедленным
и продолжительным эстрогенным действием.
Хранят с предосторожностью (список
Б), в защищенном от света месте.
Применяют для тех же целей, как
и эстрадиол-бензоат, в виде 0,1 %-ного
масляного раствора в ампулах по 1 мл 2—3 раза
в неделю.
Следует упомянуть, что сам эстрадиол
существует в виде двух эпимерных диолов, с т. пл. 178° и т. пл. 223°. Низкоплавкий
изомер обладает более подвижной гидроксильной группой и ему приписывается 17β-конфигурация
(I); он активнее своего 17α-эпимера (II) примерно в 40 раз и в 8—10 раз активнее
эстрона:

При обработке метилового эфира
эстрадиола (I) литием в жидком аммиаке в присутствии спирта (по Берчу) восстанавливается
ароматическое ядро и образуется виниловый эфир (II), который после гидролиза переходит
в непредельный кетон —нортестостерон (III), являющийся одним из активных
андрогенов:

Таким образом, превращение ароматического
ядра в циклогексановое сопровождается исчезновением эстрогенной и возникновением
андрогенной активности. С другой стороны, разрушение кольца D, при
сплавлении эстрона (IV) с едким кали, приводит к монокарбоновой дойзиноловой кислоте
(V), которая столь же активна, как и эстрон:

Следовательно, и без кольца D молекула способна обладать эстрогенной
активностью.
3.4 Определение подлинности
препаратов эстрогенов
Для установления подлинности используют
цветную реакцию с концентрированной серной кислотои в присутствии этинилэстрадиола
раствор приобретает оранжево-красную окраску с желтовато-зеленой флуоресценцией.
После добавления полученного раствора к 10 мл воды окраска изменяется до фиолетовой
и выпадает фиолетовый осадок Местранол с концентрированной серной кислотой образует
кроваво-красное окрашивание с аналогичной флуоресценцией. Эстрадиола дипропионат
под действием концентрированной серной кислоты гидролизуется с образованием эстрадиола
и пропионовой кислоты. Последующее нагревание в присутствии этанола ведет к образованию
этилового эфира пропионовой кислоты, имеющего характерный запах:

Эстрадиола дипропионат идентифицируют
по образованию эстрадиола (т. пл. 173-179°С) после щелочного гидролиза с последующей
очисткой его от примесей.
Наличие фенольного гидроксила
в молекуле этинилэстрадиола подтверждают реакцией образования бензоата этинилэстрадиола,
имеющего т. пл. 199-202°С:

УФ-спектр поглощения раствора
этинилэстрадиола в смеси этанола и гидроксида натрия в области 220-330 нм имеет
максимумы поглощения при 241 и 299 нм и минимумы поглощения при 226 и 271 нм, а
раствор в этаноле — максимум поглощения при 280 нм. Этинилэстрадиол можно отличить
по удельному показателю поглощения 0,005%-ного спиртового раствора при длине волны
280 нм. Он должен быть равен 65-69. Эстрадиола дипропионат идентифицируют по УФ-спектру
0,01%-ного раствора в этаноле, который в области 220-350 нм должен иметь два максимума
поглощения (при 269 и 276 нм). Местранол (0,005%-ный раствор в этаноле или метаноле)
при длине волны 279 нм имеет удельный показатель поглощения от 59 до 64.
Подлинность этинилэстрадиола,
местранола и эстрадиола дипропионата подтверждают по ИК-спектрам, снятым в вазелиновом
масле в области от 4000 до 200 см — 1. Они не должны отличаться от рисунков
спектров, прилагаемых к ФС. В результате проведенных систематических исследований
разработана унифицированная методика идентификации стероидных эстрогенов методом
ВЭЖХ.
Примеси посторонних стероидов
определяют методом ТСХ на пластинках Силуфол УФ — 254. В качестве свидетелей используют
СОВС эстрона, эстрадиола и др. ФС допускает суммарное содержание примесей стероидов
— не более 2%, в т. ч. в этинилэстрадиоле не более 1% эстрона.
Этинилэстрадиол количественно
определяют методом косвенной нейтрализации так же, как норэтистерон. В качестве
растворителя используют очищенный от перекисных соединений тетрагидрофуран. Выделившуюся
после добавления нитрата серебра азотную кислоту титруют 0,1 М раствором гидроксида
натрия потенциометрическим методом со стеклянным индикаторным электродом. Этинилэстрадиол
образует с нитратом серебра двойную соль, которая состоит из серебряной соли этинилэстрадиола
и шести молекул нитрата серебра:
![]()
По МФ определение этинилэстрадиола
выполняют спектрофотометрическим методом в среде безводного этанола при длине волны
281 нм. Фотоколориметрическая методика определения этинилэстрадиола основана на
использовании диазореактива (смесь сульфаниловой кислоты, нитрита натрия и хлороводородной
кислоты). В щелочной среде образуется окрашенное бисазосоединение:

Для количественного определения
эстрадиола дипропионата используют реакцию щелочного гидролиза точно отмеренным
количеством 0,1 М спиртового раствора гидроксида калия, избыток которого титруют
0,1 М раствором хлороводородной кислоты (индикатор фенолфталеин):

Для идентификации, установления
наличия примесей посторонних стероидов и количественного определения стероидных
эстрогенов (в т. ч. этинилэстрадиола, местранола, эстрадиола дипропионата) использован
комплекс физико-химических методов: ТСХ, ВЭЖХ, масс-спектрометрия (Родионова P.A.,
Тугунтаев Г.И., Арзамасцев А.П.). Ряд разработанных методик включен в ФС.
Производные эстрадиола хранят
по списку Б. Этинилэстрадиол сохраняют в хорошо укупоренных банках оранжевого стекла,
а местранол и эстрадиола дипропионат — в сухом, защищенном от света месте.
Применяют в качестве эстрогенных
средств. Учитывая пролонгированное действие эстрадиола дипропионата, его вводят
внутримышечно по 1 мл 0,1 %-ного раствора в масле 2-3 раза в неделю. Этинилэстрадиол
назначают внутрь в виде таблеток по 0,00001 и 0,00005 г. Местранол является одним
из компонентов таблеток инфекундин (Infecundin) — активного перорального
контрацептива, содержащего 0,0001 г местранола и 0,0025 г норэтинодрела. Этинилэстрадиол
входит в состав таких противозачаточных средств, как марвелон, ноновлон, овидон,
применяемых в виде таблеток.
стероидный гормон синтез животное
человек
Глава 4. Гестагенные гормоны
4.1 История
Название «гестагенные» гормоны
происходит от латинского слова — gestatio,
т. е. беременность, поэтому в более ранних
исследованиях гестагенные гормоны назывались гормонами беременности. Гестагенные
гормоны были выделены в результате исследования функций желтого тела (Corpus luteum), периодически образующегося после овуляции и развивающегося
после оплодотворения. Как показал Френкель в 1902 г., удаление желтого тела у беременных
животных приводит к выкидышу плода. Исследованиями Окинчица, Леба и других авторов
показано, что главной функцией желтого тела является подготовка слизистой оболочки
матки к имплантации оплодотворенного яйца и поддержания дальнейшего развития зародыша.
Однако только через 20 лет Корнеру и Аллену (1932) удалось экспериментально доказать,
что желтое тело производит гормон, необходимый для поддержания беременности. Гормон
этот также тормозит овуляцию и подвижность матки, сенсибилизирует последнюю к восприятию
зародыша и способствует имплантации яйцеклетки. Помимо этого, гормон оказывает влияние
и на развитие молочных желез. Выделение гормона желтого тела в чистом виде оказалось
возможным лишь после разработки биологических тестов, позволивших определять лутоидмую
активность. По Клаубергу, неполовозрелым крольчихам в течение 8 дней вводят ежедневно
по 10 МЕ (мышиных единиц) эстрогенного гормона, затем в течение 5 дней вводят подкожно
гестагенный гормон. Наименьшее количество вещества, вызывающее в слизистой оболочке
матки изменения, подобные наблюдаемым в начале беременности, цазывается кроличьей
единицей (КЕ). Эстрогенные гормоны уже в весьма небольших количествах (0,1 мкг)
подавляют лутоидное действие гормона желтого тела, названного прогестероном. Поэтому
экстракты перед испытанием обрабатывают 30%-ным раствором едкого натра для отделения
эстрогенных (фенольных) гормонов.
По международному соглашению,
1 ME гормона желтого
тела соответствует 1 мг стандартного кристаллического прогестерона.
Впервые прогестерон (II) выделен
Бутенандтом в 1934 г. из желтого тела свиней (спустя 6 лет после открытия эстрона).
Строение его было выведено на основании аналитических и спектральных данных, подтвержденных
частичным синтезом из прегненолона (I); сам прегненолон получен при окислении 3-ацетата
5,6-дибромхолестерина:

Ввиду малых выходов (1—3%) этот
способ не получил практического использования. Более пригодным оказалось получение
прогестерона (II) из неомыляемой части масла соевых бобов — стигмастерина (III), путем
окислительного расщепления последнего через прегненолон (I):

При бромировании стигмастерина
образуется с присоединением брома к 5—6 двойной связи дибромид стигмастерина (IV),
который при озонировании превращают в озонид (V), а при последующей обработке цинком
и уксусной кислотой в 3β-оксибиснорхоленовую кислоту (VI):
После этерификации кислоты (VI)
с помощью диазометана в метиловый эфир (VII) последний с помощью магний-бромфенила
превращают в третичный карбинол (VIII).

При кипячении его с ледяной уксусной
кислотой и перегонке в высоком вакууме происходит дегидратация и образуется дважды
непредельный спирт (IX), изолированный в виде ацетата. Озонированием его переводят
в прегненолон и затем окислением в прогестерон:

Описаны многочисленные синтезы
прогестерона из прегненолона с применением различных окислителей (перманганата калия,
перекиси водорода, хромового ангидрида) дегидрирующих веществ — металлических акцепторов
водорода Сu, Ag, Аu, Рt, Рd, Ni, Zn), а
также кетонов, альдегидов, ненасыщенных соединений, например, коричной, фумаровой
кислот, хинолина.
Хорошие выхода получают при окислении
по Оппенауэру с применением третичного бутилата алюминия.
Окисление прегненолона может быть
проведено и микробиологически с помощью Rhizopus nigricans, как это показано
Мамоли (1938).
При использовании в качестве исходного
продукта 3(β)-ацетокси-Δ5— этиохоленовой кислоты (X) ее превращают
с помощью тионилхлорида в хлорангидрид (XI), который восстанавливают в альдегид
(XII) и затем через 3-окси — 17-метил-магний-йод гидролизуют при охлаждении разбавленной
серной кислотой. При перекристаллизации из смеси ацетон-вода получают чистый прегнендиол — 3,20
(XIII), который окисляют хромовой кислотой в ледяной уксусной кислоте обычным путем
в прегненолон (I):

Н.Н. Суворовым (1956) показано,
что прогестерон может быть получен из соласодина-агликона стероидных алкалоидов,
получаемого из растения паслен птичий (Solanum aviculare Forst) по схеме.
Дальнейшее превращение Δ5,16-прегнадиенол — 3-она — 20
(III) в прогестерон (II), связано с гидрированием, гидролизом
ацетильной группы и реакцией Оппенауэра:

4.2 Прогестерон
Progesteronum. Прогестерон. 4-прегнен — 3,20-дион. С21Н30О2.
М = 314,47.

Синонимы: Lutocyclin, Progestin, Progeston, Proluton и др.
Прогестерон — белый кристаллический
порошок, т. пл. 127—129°, удельный показатель поглощения 515 (0,001, 95%-ный спирт
при к = 241 ммк), не растворим в воде, растворяется в спирте, эфире, хлороформе,
мало растворим в растительных маслах. Спиртовой раствор в присутствии щелочи и м-динитробензола
окрашивается в красно-фиолетовый цвет, раствор его в смеси концентрированной уксусной
кислоты и 88%-ной фосфорной дает интенсивную желтую флуоресценцию (реакция Боскотта).
Являясь кетоном, образует оксим, т. пл. 240°, и 2,4-динитрофенилгидразон.
Количественное определение прогестерона
производят весовым путем, в виде 2,4-динитрофенилгидразона, получаемого кипячением
препарата с реагентом в спиртовом растворе. После кипячения его с концентрированной
соляной кислотой осадок отфильтровывают, промывают 0,5 н. раствором соляной кислоты,
спиртом и высушивают при 100° до постоянного веса. Вес осадка, умноженный на 0,466,
соответствует количеству прогестерона.
Содержание прогестерона в препарате
должно быть не менее 98,5%. Хранят с предосторожностью (список Б), в хорошо закупоренных
банках, в защищенном от света месте.
Высшая разовая доза—0,01 г, суточная
— 0,01 г. Применяют при патологических процессах, связанных с недостаточностью желтого
тела: при дисфункциональных маточных кровотечениях, функциональной и анатомической
недостаточности половых органов, болезненных менструациях, привычном и угрожающем
выкидыше, бесплодии. Вводят в виде масляных растворов внутримышечно или подкожно
по 0,01 г (2 мл 0,5-ного раствора в масле). Выпускают в ампулах по 1 мл.
По своему строению прогестерон
отличается от андрогенных гормонов наличием при С17 боковой цепи; такие
соединения относятся к группе прегнана. Так как андрогены получаются легче и с лучшими
выходами, нежели производные прегнана, то последние обычно получают из производных
андростана.
В 1936 г. Бутанандт, а также Ружичка
с помощью гриньяровского синтеза получили впервые 17-этилтестостерон; этот продукт
оказался слабым эстрогеном и неактивным в отношении теста Клауберга. Более важными
оказались производные ацетилена и, в частности, 17-этинил тестостерон, строения:

названный прегнином.
4.3 Прегнин
Praegninum. Aethisteronum. Прегнин. 17-α-этинилтестостерон. Δ4 — 17-этиниландростен — 3-он — 17-ол.
С21Н28О2. М = 312,46

Прегнин — белый или слегка желтоватый
кристаллический порошок без запаха, т. пл. 268—274°, не растворим в воде, мало растворим
в спирте и ацетоне, хлороформе и в пиридине. С гидрохлоридом гидроксиламина в присутствии
ацетата натрия в среде метилового спирта образует оксим, который, после перекристаллизации
из 70%-ного метилового спирта, плавится при 226—232°. Раствор в концентрированной
серной кислоте при разбавлении водой и прибавлении хлороформа окрашивает последний
в красный цвет.
Чистоту препарата определяют по
отсутствию примесей (сульфатная зола не должна превышать 0,1%, а потеря в весе при
высушивании до постоянного веса при 100° —0,5%).
Хранят с предосторожностью (список
Б), в хорошо закупоренных банках, в сухом месте, защищенном от действия света. Высшая
разовая доза — 0,015 г, суточная —0,05 г.
Применяют по 2 таблетки (по 5
мг) 3 раза в день; он в 5—6 раз менее активен, нежели прогестерон. Особенностью
прегнина является его свойство сохранять активность и оказывать терапевтическое
действие при приеме внутрь, особенно сублингвально.
При гидрировании двойной связи
прегнина или замене карбонильной группы гидроксильной активность утрачивается, но
при расширении пятичленного цикла D до шестичленного
— D-гомопрогестерон
обнаруживает почти такую же активность, как и прогестерон. Синтез D-гомопрогестерона
представляет собой точное повторение синтеза прогестерона из 3-ацетата Дегидроэпиандростерона — 17.
При действии на последний (I) синильной кислоты получен оксинитрил (II), который
восстановлением литийалюминийгидридом превращен в оксиамин (III) и при обработке
азотистой кислотой в гомодегидроэпиандростерон (IV). С помощью реакции Оппенауэра
и др. (IV) Превращается в D-гомопрогестерон (V):

Превращение III в IV под влиянием
азотистой кислоты является известной перегруппировкой Демьянова. Не только замена
пятичленного цикла на шестичленный, но и удаление С19-метильной группы
не изменяет гормональных свойств; активность молекулы повышается и 19-норпрогестерон
(VI) в 7—8 раз активнее прогестерона.
При синтезе 19-норпрогестерона
исходят из метилового эфира эстрона (VII) и боковую цепь образуют аналогично предыдущему.
Действием реактива Гриньяра на нитрил (VIII), образующийся в результате дегидратации
оксинитрила (II), получают после гидрирования кетон (IX). При восстановлении ароматического
кольца (Л) литием в жидком аммиаке восстанавливается и карбонильная группа (IX),
но гидролиз образовавшегося винилового эфира (X) приводит к α,β-непредельному
кетону (XI), который при окислении хромовым ангидридом переходит в 19-норпрогестерон
(VI):


Исходя из метилового эфира эстрона,
был получен по нижеприведенной схеме 19-норпрегнин (норлутин), оказавшийся в 3—4
раза активнее прегнина с транс-сочленением колец В/С и С/D:

В 1957 г. Эренштейн в США получил
19-норпрогестерон с цис-сочленением колец С/D и α-положением боковой цепи (-СОСН3) строения:

Его активность оказалась в 8 раз
выше активности прогестерона. Этот факт заслуживает внимания, так как ранее принималось,
что стероиды с цис-сочленением колец С/D являются неактивными. Для получения 19-норпрогестерона
ацетат строфантидина (I) окислялся перманганатом калия в щелочной среде и образовавшаяся
за счет «лактонного» кольца с одной стороны и альдегидной группы с другой кетокислота
(II) самопроизвольно замыкалась в лактон (III). При обработке последнего перекисью
водорода, в присутствии щелочи, боковая цепь окислялась до карбоксильной группы,
причем под влиянием щелочи происходила инверсия у С17, в результате чего
получилась кислота (IV). При действии хлористого водорода на (IV) наступала дегидратация
с образованием V, а при последующем гидрировании получалась кислота с цис-сочленением
колец С и D (VI).
При нагревании до 200° удалялись ангулярные — ОН группа при С14 и СООН
— группа при С10 и образовывалась непредельная при Q—С10
ацетоксикислота (VII). Действием оксалилхлорида на (VII) получался хлорангидрид
(VIII), который с диметилкадмием превращался в оксикетон (IX) и затем по Оппенауэру
в 19-норпрогестерон (X):


Из аналогов прегнина, содержащего
при С6 и С21 метильные группы, следует отметить полученный
В. Петровым (Англия). Действием ацетиленида лития в жидком аммиаке на 3-ацетат дегидроэпиандростерона — 17
(I) синтезирован 3,17-диол (II), гидроксильные группы которого защищались дигидропираном
и дигидропиранилдиол (III) обрабатывался последовательно бутиллитием и йодистым
метилом, что после гидролиза привело к пропинилдиолу (IV). Окислением диола (IV)
по Оппенауэру синтезирован соответствующий кетон (V) и из него этиленкеталь (VI).
При действии на кеталь (VI) надфталевой кислоты получена соответствующая окись (VII),
которая с магнийбромметилом, с разрывом окисного кольца, превращена в гликоль (VIII).
Кислым гидролизом гликоль (VIII) превращен в кетодиол (IX) и действием едкого натра
в пиридине — в кетон (X). При действии на кетон (X) хлористого водорода образуется
эпимер, переходящий в α-метилпроизводное (XI), оказавшееся в 12 раз активнее
прегнина:

4.4 Определение подлинности
препаратов гестагенов
Для испытания подлинности прогестерона
фс рекомендует цветную реакцию на наличие стероидного цикла с концентрированной
серной кислотой. После добавления 3 мл воды образуется желтое окрашивание с зеленой
флуоресценцией. После добавления хлороформа оба слоя становятся бесцветными. Спиртовой
раствор прогестерона образует с м-динитро-бензолом в щелочной среде окрашенное в красный цвет соединение.
По ФС прогестерон идентифицируют
о помощью ИК-спектра, снятого в вазелиновом масле в области 3700-400 см — 1.
Он должен полностью совпадать с прилагаемым к ФС рисунком спектра.
УФ-спектрофотометрию, основанную на измерении оптической
плотности при 241 нм (максимум светопоглощения). применяют для идентификации прогестерона.
Для норэтистерона НД указывает
максимум поглощения 240 нм В качестве растворителя используют этанол.
Реакция образования оксима за
счет наличия кетогруппы в положении 3 стероидного цикла может быть использована
для испытания подлинности норэтистерона:

Реакцию осаждения 2,4-динитрофенилгидразона
используют для количественного определения прогестерона (гравиметрическим методом)
и для испытания его подлинности (по температуре разложения 2,4-динитрофенилгидразона):

Наличие спиртового гидроксила
в молекуле норэтистерона позволяет использовать для испытания на подлинность реакцию
ацетилирования:

Ацетат норэтистерона — белое кристаллическое
вещество (т. пл. 158- 163°С), растворимое в этаноле, ацетоне и хлороформе.
Для испытания на подлинность и
на присутствие посторонних примесей в прогестероне, норэтистероне и медроксип- рогестерона
ацетате ФС и МФ рекомендуют метод ТСХ на пластинках Силуфол УФ — 254 или с использованием
в качестве адсорбента кизельгура Р1 (силикагеля Р1). Оценку производят после проявления
хроматограмм путем сравнения положения, внешнего вида и интенсивности окраски основного
пятна у испытуемого раствора и стандартного образца. Допустимое содержание примесей
посторонних стероидов в прогестероне не должно превышать 1,5%.
Подлинность медроксипрогестерона
ацетата подтверждают также по положительной реакции на ацетилированные соединения.
Норэтистерон можно количественно
определить методом косвенной нейтрализации. В его основе лежат следующие химические
реакции:

Атом водорода этинильного радикала
замещается катионом серебра, образуя ацетиленид серебра. Выделившееся эквивалентное
количество азотной кислоты оттитровывают гидроксидом натрия.
Количественное определение прогестерона
по ФС выполняют спектрофотометрическим методом в максимуме поглощения (241 нм),
используя в качестве растворителя этанол. Расчет содержания в пересчете на сухое
вещество выполняют по величине предварительно установленного удельного показателя
поглощения (535).
Определение содержания норэтистерона
в таблетках выполняют методом УФ-спектрофотометрии при 263 нм, сравнивая оптическую
плотность со стандартным образцом.
Описаны способы анализа прогестерона
и его синтетических аналогов методом ВЭЖХ на колонках с прямой и обращенной фазами.
Методика контроля качества смеси стероидных соединений прегнанового ряда предусматривает
такие критерии разделения, как время удерживания, селективность, разрешение. Согласно
требованиям НД фирм, производящих медроксипрогестерона ацетат, испытания на подлинность,
однородность дозирования, наличие посторонних примесей и количественное определение
выполняют методом ВЭЖХ. Подлинность подтверждают по сравнительному времени удерживания
основного пика на хроматограмме у испытуемого и стандартного образцов. Последние
используют в качестве внутреннего стандарта при выполнении количественного определения.
Прогестерон, норэтистерон и медроксипрогестерона
ацетат хранят по списку Б, в сухом месте, в хорошо укупоренной таре, предохраняющей
от действия света, при температуре не выше 20-25°С. Применяют в качестве гестагенных
препаратов. Прогестерон назначают в виде 1%-ного или 2,5%-ного раствора в масле
для инъекций. Норэтистерон сохраняет активность при подъязычном применении. Его
назначают в виде таблеток «Норколут», содержащих по 0,005 г норэтистеро- на. Медроксипрогестерона
ацетат проявляет не только гестагенное, но и противоопухолевое действие, особенно
при раке матки и молочной железы. Назначают его внутрь в таблетках по 0,1-0,4 г,
а также в виде растворов для инъекций в ампулах по 150 мг/мл. Депо-провера вводят
внутримышечно в виде суспензии по 3,3 мл (0,5 или 0,15 г в 1 мл).
Глава 5. Кортикостероидные
гормоны
5.1 Характеристика
В надпочечниках различают корковый
и мозговой слои. Мозговой слой выделяет гормон адреналин, обладающий сосудосуживающим
действием. Из коры надпочечников выделено 29 кристаллических стероидных соединений,
получивших название кортикостероидов, из которых 6 оказались способными продлевать
жизнь адреналэктомированных животных. Все они являются прегнановыми производными,
содержащими в кольце А Δ4 — 3-кетонепредельную группировку, а в положении
17-кетольную или диоксиацетоновую цепочку; часть из них при Сп имеет
карбонильную или гидроксильную группу. Упомянутые кристаллические соединения обладают
различной активностью как в качественном, так и в количественном отношениях. Так,
дезоксикортикостерон (II), который относят к минералокортикоидам, регулирует солевой
обмен; он способствует задержке в организме воды, натрия и повышает выделение из
организма калия; кроме того, он усиливает явление анаболизма (синтез белка) и воспалительные
процессы (повышает «воспалительный потенциал» организма), т. е. способность отвечать
на раздражение воспалительной реакцией. Кортизон и другие родственные стероиды относят
к глюкокортикоидам; они влияют на углеводный и белковый обмен и меньше на солевой
обмен. По химическому строению стероидные гормоны надпочечников являются производными
прегнана (I):

они могут быть разделены на 11-дезоксистероиды,
например дезоксикорти костерон (II),
11-оксистероиды (III) и 11,17-диоксистероиды
(IV)—кортизон и родственные ему соединения:

Представители глюкокортикоидов
способствуют накоплению гликогена в печени, повышают содержание сахара в крови,
вызывают увеличение выделения азота с мочой, обладают противовоспалительным действием.
Адренокортикотропный гормон гипофиза
(АКТГ) является физиологическим стимулятором коры надпочечников, без которого невозможна
нормальная функция последней.
5.2 Дезоксикортикостерон-ацетат
Desoxycorticosteronum aceticum. Desoxycorticosteroni acetas. Desoxycortoni acetas. Дезоксикортикостерон-ацетат.
11-дезоксикортикостерон — 21-ацетат. С23Н32О4. М
= 372,51.

Синонимы: Соrtеnil, Соrtехоn, Соrtiron,
DОСА и др. В отличие от многих кортикоидов, дезоксикортикостерон
получен впервые в 1937 г. не изолированием из органов, а полусинтетическим путем
(Штейгер, Рейхштейн) из 3β-ацетокси — 5-этиеновой кислоты (I) — побочного продукта
окисления 5,6-дибром — 3-ацетата холестерина при синтезе дегидроэпиандростерона. С
помощью тионилхлорида кислота эта превращена в хлорангидрид (II) и затем с помощью
диазометана в диазокетон (III). При гидролизе 3-ацетильной группы едкой щелочью
получен (IV), который ацетолизом превращен в 21-ацетокси — 5-прегнен — 3-ол — 20-он. После
присоединения одной молекулы брома образующийся дибромид (VI) окислен хромовой кислотой
до 3-кетопроизводного (VII) и дебромированием цинковой пылью получен дезоксикортикостерон-ацетат
(VIII):

В дальнейшем метод этот (1940)
был улучшен; диазокетон по Оппенауэру окислен до 21-диазопрогестерона (IV) и затем
уже ацетолизом превращен в дезоксикортикостерон-ацетат (VIII).
Как показал далее Рейхштейн, 3-кето — 4-этиеновая
кислота (X), полученная окислением хромовой кислотой Зβ-окси — 5-этиеновой кислоты
(IX), после предварительного присоединения брома к двойной связи и последующего
дебромирования, может быть превращена в 21-ацетоксипрегнан — 3,20-дион (XIII), при
бромировании с заменой водорода у С4 (XI) и отщеплении бромистого водорода
с помощью пиридина (XII), а также других реакций, описанных ранее:

Вилдс и Шунк (1948) показали,
что при действии оксалилхлорида на натриевую соль 3-кето — 4-этиеновой кислоты (X)
образуется хлорангидрид, который диазометаном переводят в 21-диазопрогестерон и
действием затем уксусной кислоты в дезоксикортикостерон-ацетат.
Лучшие выхода получены Шормом
и Черни (1952) при присоединении цианистого водорода к дегидроэпиандростерон-ацетату,
отщеплении воды и селективном гидрировании дегидронитрила в присутствии Рd-СаСO3. При гидролизе образуется кислота I:

Еще в 1939 г. дезоксикортикостерон-ацетат
был получен из дегидроэпиандростерона присоединением ацетилена, с частичным гидрированием
17-виниландростен — 3,17-диола и его окислением с помощью четырехокиси осмия до глицеринового
производного. При отщеплении воды образуется дезоксикортикостерон; еще лучше ацетилированный
продукт путем перегонки с цинковой пылью превращать в дезоксикортикостерон-ацетат;

Практическое значение имеет использование
Зβ-окси — 5-холеновой кислоты (I), получаемой в качестве побочного продукта при
окислении холестерилацетатдибромида.
После превращения ее в метиловый
эфир и действия 2 мол магний-бром-фенила получают соответствующий третичный спирт,
который ацетилируют. При отщеплении воды кипячением с уксусной кислотой и дезацетилировании
с помощью поташа вторичная спиртовая группа при С3 окисляется по Оппенауэру
и бромированием с помощью N-бромсукцинимида, а также последующим отщеплением бромистого
водорода с помощью диметиланилина получают диен. При дальнейшем действии N-бромсукцинимида
на свету образуется 21-бромпроизводное, от которого боковую цепь отщепляют хромовой
кислотой после предварительного ацетилирования:

В дальнейших, технически важных
синтезах в качестве исходного продукта использовали 5-прегнен — 3-β-ол — 20-онацетат.
При обработке его тетраацетатом свинца образуется 21-ацетоксипроизводное, которое
при действии раствора гидрокарбоната калия селективно деацетилируется у С21
и полученное соединение с помощью хлористого тнонила превращают в С21-хлорид,
а при дезацетилировании при С3 и окислении по Оппенауэру — в 21-хлорпрогестерон.
При взаимодействии последнего с ацетатом натрия образуется дезоксикортикостерон-ацетат:

Дезоксикортикостерон-ацетат —
белый или белый с кремовым оттенком кристаллический порошок без запаха, т. пл. 154—160°.
Растворим в хлороформе, ацетоне, диоксане и спирте, не растворим в воде. Вращает
плоскость поляризации вправо. Удельный показатель поглощения 430 (с = 0,001, 95%-ный
спирт) при 240 ммк. Восстанавливает аммиачный раствор нитрата серебра и окрашивается
концентрированной серной кислотой; при прибавлении хлороформа последний окрашивается
в оранжевый цвет с красной флуоресценцией, водный слой окрашивается в зеленоватый
цвет.
Чистоту препарата определяют по
отсутствию сульфатной золы и потере в весе (допускается потеря при высушивании до
постоянного веса при 100—105° не более 0,5%).
Хранят с предосторожностью (список
Б), в банках оранжевого стекла с притертыми пробками, в сухом месте.
Высшая разовая доза — 0,01 г,
суточная — 0,02 г.
Применяют при болезни Аддисона,
общей мышечной слабости и других заболеваниях внутримышечно в масляных растворах
по 5 мг 3 раза в неделю до 10 мг ежедневно. Препарат вызывает задержку ионов натрия
и повышение выделения калия; противопоказан при гипертонической болезни, сердечной
недостаточности, атеросклерозе и др.
5.3 Кортизон-ацетат
Cortisonum aceticum. Cortisoni acetas.
Кортизон-ацетат. 11-дегидро — 17-α-оксикортикостерон — 21-ацетат Δ4-прегнендиол — 17α,21-трион — 3,11,20,21-ацетат. С23н30о6. М = 402,5.

Синонимы: Аdreson,
Соrtisуl, Соrtоnе.
Описаны многочисленные методы
синтеза; из них практический интерес имеют лишь те, которые приводят к значительным
выходам.
Всего целесообразнее исходить
из прогестерона, который с помощью микробиологического окисления превращают в 11-оксипрогестерон
и затем окислением в кортизон:

Петерсоном с сотрудниками (1953)
было показано, что для синтеза кортизона целесообразно использование вещества S Рейхштейна (I), которое при окислении
превращают в 11-эпигидрокортизон (II); при окислении ацетата последнего образуется
кортизон (III):

Вещество S Рейхштейна не получило медицинского
применения, но оказалось важным для синтеза кортизона. Еще в 1937 г. автором было
показано, что оно может быть синтезировано из дегидроэпиандростерона по схеме:
Как следует из схемы, необычным
является образование диена (IV), который возникает в результате дегидратации (II),
и перегруппировка (V) в (VI), под влиянием пиридина, открытая еще в 90-х годах Лобри-де-Брюином
на примере глицеринового альдегида, изомерирующегося в диоксиацетон.

Синтез кортизона осуществлен также
по методу Н.Н. Суворова из прогестерона (I) с применением микробиологических реакций.
С помощью плесневого грибка Rhizopus nigricans [I] окисляют
до И ос-оксипрогестерона (II) и двойную связь при С4 гидрируют в присутствии
палладия, осажденного на кальции карбонате, при обычных условиях в среде пиридина
до образования прегнанол — 11α-диона — 3,20 (III). Последний подвергают окислению
бихроматом калия в присутствии серной кислоты и образовавшийся прегнантрион — 3,11,20
(IV) вновь восстанавливают в пиридиновом растворе боргидридом натрия. При выливании
в охлажденную разбавленную соляную кислоту выделяется прегнанол — 3α-дион — 11,20
(V). С целью получения прегнандиол — 3α,17α-диона — 11,20 (VIII), прегнанол — 3α-дион — 11,20
(V) подвергают кипячению с уксусным ангидридом и получают енолацетат (VI), который
окисляют надфталевой кислотой. Образовавшуюся окись (VII) гидролизуют 1%-ным водно-метанольным
раствором едкого натра и продукт реакции — прегнандиол — 3α,17α-дион — 11,20
(VIII) извлекают хлороформом.
Бромирование (VIII) производят
диоксандибромидом, в результате чего получают 21-бромпрегнан-диол — 3α,17α-дион — 11,20
(IX). Окисление производят бромсукцинимидом в метаноле при обычной температуре;
при этом образуется 21-бромпрегнанол — 17α-трион — 3,11,20 (X). Для получения ацетата
дигидрокортизона (XI) 21-бромпрегнанол — 17α-трион — 3,11,20 нагревают в диметилформамиде
с безводным ацетатом натрия и продукт реакции высаживают водой.
Бромирование ацетата дигидрокортизона
(XI) производят диоксандибромидом в диметилформамиде в присутствии катализатора
п-толуолсульфокислоты и полученный бромид (XII) высаживают водой. Превращение бромида
(XII) в семикарбазон кортизон-ацетата (XIII) производят обработкой семикарбазидом
в смеси хлороформа и третичнобутилового спирта. При растворении последнего в уксусной
кислоте и действии пировиноградной кислоты происходит пересемикарбазирование и образуется
кортизон-ацетат (XIV):

Кортизон-ацетат — белый
или белый с желтоватым оттенком порошок, т. пл. 235—245° (с разл.), не растворим
в воде, мало растворим в спирте и в ацетоне, растворяется в хлороформе, вращает
плоскость поляризации вправо. Удельный показатель поглощения 390±10 (с = 0,001,
95% спирт) при 238 ммк. При нагревании до 70° метанольного раствора препарата с
раствором фенилгидразинсульфата возникает желтая окраска, а при щелочном гидролизе
спиртовым раствором едкого кали и прибавлении серной кислоты ощущается запах этилацетата.
Раствор препарата в концентрированной серной кислоте обнаруживает желтую флуоресценцию,
которую лучше наблюдать при нанесении на белую фарфоровую пластинку (отличие от
преднизона).

Чистоту препарата определяют по
отсутствию галогена (проба Бейльштейна), потере в весе (не более 0,5% при высушивании
до постоянного веса при 100—105°), золы, семикарбазона кортизонацетата (минерализованный
концентрированной серной кислотой в присутствии пергидрола препарат с реактивом
Несслера в щелочной среде не должен обнаруживать более интенсивной окраски, нежели
эталон на аммиак, приготовленный с теми же реактивами по ГФ).
Кортизон-ацетат количественно
может быть определен по оптической плотности при реакции с антроном в концентрированной
серной кислоте.
Кортизон-ацетат растворяют в абсолютном
спирте (примерно 1 мг в 1 мл), часть раствора доводят до объема в 2 мл абсолютным
спиртом, прибавляют 2 мл реактива (0,2%-ный раствор анилина в 96%-ной серной кислоте)
и спустя 1 ч оптическую плотность определяют при 480 ммк спектрофотометром.
Хранят с предосторожностью (список
Б), в стеклянных, хорошо закупоренных банках, в защищенном от света месте. Высшая
разовая доза — 0,15 г, суточная —0,3 г.
Применяют внутрь и внутримышечно
при ревматизме, подагрических, инфекционных и псориатических артритах, бронхиальной
астме, острых лейкозах и других заболеваниях. Детям кортизон назначают внутримышечно,
начиная с 0,05 г 2 раза в день. Выпускают в порошках, таблетках по 0,025 и 0,05
г, флаконах по 5 и 10 мл суспензии, содержащей 25 мг в 1 мл.
5.4 Производные и аналоги кортизона
Синтез и изучение аналогов и производных
кортизона привел к ряду интересных соединений, получивших применение в медицине.
К ним относится гидрокортизон (I), преднизон (II), преднизолон (III) и др.:

Гидрокортизон (I) оказался несколько
более активным, чем кортизон; 2/3 его дозы соответствуют примерно
1 дозе кортизона. Преднизон (II) активнее кортизона в 3—5 раз, а преднизолон (III)
по действию близок к преднизону. При замене пятичленного кольца (D) кортизона
на шестичленное активность уменьшается на 30—60%. Пониженную активность обнаруживает
и 19-норкортизон, строения:
При введении а-метильной группы
в положение 16 активность возрастает примерно на 50% (Хогг); аналогично 2-метилкортизон
в несколько раз активнее кортизона. 2-Метилгидрокортизон в 10 раз выше активности
гидрокортизона.

Введение галогена в кортизон или
гидрокортизон повышает их физиологическое действие (Хогг, Фрид и Сабо); 9-фторпреднизолон
по Хоггу в 50 раз активнее преднизолона. Введение фтора в другие положени я молекулы
гидрокортизона резко усиливает их действие. Еще более активен ацетат 6α,9α-дифтор — 16α-метилпреднизолона,
который в 700 раз активнее гидрокортизона.
Кортизон и его аналоги широко
применяют при лечении ревматоидных артритов. Больные, прикованные к постели, приобретают
способность двигаться; острые боли исчезают, но терапия кортизоном, однако, не уничтожает
причину заболевания, и боли иногда возникают вскоре после прекращения приема кортизона
или кортизоноподобных препаратов. При длительном их применении возникает остеопороз.
5.5 Гидрокортизон
Нydrocortisonum. Гидрокортизон. 17-оксикортикостерон. 4-прегнен — 11β,17α,21-триол — 3,20-дион.
С21Н30О4. М = 346,24.

Синонимы: Cortisol, Cortril, Hydrocortal и др.
По химическому строению гидрокортизон
отличается от кортизона наличием при С11-гидроксильной группы (вместо
карбонильной). Получают биохимическим путем, полусинтезом из кортизона или чисто
химическим путем.
Биохимическим путем получают окислением
вещества S Рейхштейна
с помощью Curvularia lanata с 40%-ным выходом (1955) или из прогестерона (1954).
Полусинтетическим путем получен
различными методами.
Хорошие выходы достигнуты при
взаимодействии кортизона (I) с этиленгликолем в присутствии п-толуолсульфокислоты;
образующийся 3,20-бисэтиленкеталь (II) восстанавливают LiА1Н4
до вторичной спиртовой группы при С11, после чего обе этиленгликолевые
группы гидролитически распадаются и ацетилированием получают вещество S (III):

Новые полусинтетические методы
описаны Оливето с сотрудниками (1953—1956), которые исходили из прегнан — 11β,17α-диол — 3,20-диона,
дезоксихолевой кислоты или из прегнан — 3α,11β,17α-триол — 20-она. Из
последнего получен гидрокортизон — 11-формиат — 21-ацетат, который после гид- ‘ролиза
обеих эфирных групп привел к желаемым результатам.
17-Гидрокортизон — белый кристаллический
порошок, т. пл. 217— 220°, мало растворим в воде. Применяют для тех же целей, что
и кортизон. Растворы готовят на изотоническом растворе натрия хлорида или на 5—10%-ном
растворе глюкозы из расчета 0,2 мг гидрокортизона в 1 мл.
Гидрокортизон-ацетат — белый кристаллический
порошок, т. пл. 223—225°, не растворим в воде. Получают ацетилированием гидрокортизона.
При кислотном или щелочном гидролизе образуется наряду с гидрокортизоном уксусная
кислота.
При внутримышечном введении в
виде суспензии оказывает такое же действие, как кортизон-ацетат. При местном применении
оказывает противовоспалительное действие. Применяют также в виде 1—2,5 %-ной мази
при аллергических дерматозах; в глазной практике применяют 0,2— 0,5%-ную суспензию
(по 1—2 капли каждые 2—4 ч) или мазь (3—4 раза в день) при лечении кератитов, конъюнктивитов,
иритов.
5.6 Альдостерон
Аldostеronuм. Альдостерон. 11β,21-диокси-Δ4-прегнен — 3,20-дион — 18-аль.
С20Н29О5. М = 349,23.

Впервые выделен из желез надпочечников
в 1953 г. Симпсоном с сотрудниками (Швейцария). Частичный синтез из лактона кортикостеронкислоты
(I) осуществлен Эувом с сотрудниками в 1955 г. Лактон этот превращен в 3,20-бис-этиленкеталь
(II), восстановлен литий-алюминий-гидридом до циклополуацеталя (III) и освобожден
кислым гидролизом от этиленгликольных остатков:

Шмидлин с сотрудниками (1955)
осуществили частичный синтез альдостерона, исходя из диолэтиленкеталя (IV) Саретта
окислением его до оксикетона (V). С помощью диэтилкарбоната ими получен кетоэфир
(VI), алкилированием которого СН3J и восстановлением продукта натрий-бор-гидридом, а также
циклизацией после щелочного гидролиза получен лактон (VII). Окислением хромовым
ангидридом в пиридине кетогруппа регенерирована в положении I и реакцией с этоксиэтинилмагнийбромидом
получен ацетиленовый карбинол (VIII). При последующем гидроксилировании в присутствии
четырехокнси осмия и селективном восстановлении тройной связи в присутствии палладия
была введена диольная группировка (IX). Окислением йодной кислотой получено производное
ацетона (X), которое с помощью трехбромистого фосфора или тионилхлорида превращено
в непредельный альдегид (XI).
При гидрировании с палладием получен
изомер (XII), который действием бензойной кислоты и триэтиламина, в кипящем ксилоле,
циклизован с образованием производного Δ5,16-прегнадиена (XIII).
При дальнейшем гидрировании с палладием была удалена Δ16-двойная
связь и полученный кетон (XIV) сконденсирован с диметилоксалатом до глиоксалата
(XV). Йодированием и последующим метанолизом получен йодкетон (XVI), из которого
ацетатом калия в ацетоне и последующим кислым гидролизом уксусной кислотой получен
лактон 21-ацетата рацемической кетостерон — 18-кислоты (XVII). При дезацетилировании
хлорной кислотой образующийся оксикетон (XVIII) был переведен в 3,20-бис-этиленкеталь
(XIX). Восстановлением литийалюминийгидридом получен 3,20-бис-этиленкеталь альдостерона
(IV) и кислым гидролизом — рацемический альдостерон:



С помощью микробиологического
21-гидроксилирования удалось этот синтез существенно укоротить и получить оптически
активный (+) альдостерон (Витер с сотрудниками, 1956). Так, кислым гидролизом рацемического
этиленкеталя (XIV) прогестероновое производное (XX) с помощью микроорганизма Ophiobolus herpotrichus гидроксилировано в позиции 21, причем реагировал только
один из обоих антиподов, в результате чего получен чистый лактон (+) кортикостерон — 18-кислоты
(XVIII). Затем через оптически активный промежуточный продукт (XIX) и (IV) он переведен
в (+) альдостерон.
Альдостерон — бесцветные кристаллы, т. пл. 164—169 (гидрат плавится
при 105—112°, причем плав вновь затвердевает и вторично плавится при 155—165°.
Альдостерон приблизительно в 100 раз активнее дезоксикортикостерона
и известных минералкортикоидов. При адиссоновой болезни он действует в дозах в 20—30
раз меньших, чем дезоксикортикостерон. 21-Моноацетат альдостерона в 1,25 раза и
диацетат в 136 раз менее активен, чем альдостерон (Симпсон с сотрудниками,
1953—1955).
5.7 Преднизон

Prednisonum. Преднизон. Метикортен.
Δ1,4-прегнандиендиол — 17α,21-tpиoh — 3,11,20 или Δ1-дегидрокортизон.
С21Н26О5. М = 358,44.
Синонимы: Decortin.
Получают из кортизон-ацетата микробиологическим
путем с помощью Mycobacterium и Bacillus
megatherium. При этом происходит
дегидрирование и дезацетилирование.
Преднизон—белый кристаллический
порошок без запаха, горького вкуса, т. пл. 227° (с разл.), не растворим в воде,
мало растворим в хлороформе, в метиловом и этиловом спиртах. Фенилгидразинсульфат
в метанольном растворе вызывает желтую окраску; концентрированной серной кислотой
окрашивается также в желтый цвет (в отличие от преднизолона). При нанесении этого
раствора на белую фарфоровую пластинку и рассматривании в ультрафиолете наблюдается
желтовато-зеленая флуоресценция (отличие от кортизон-ацетата).
Чистоту препарата определяют по
отсутствию влаги при высушивании до 100—105° (не более 0,5%), остатка при прокаливании.
Оптическую плотность D раствора измеряют при длине волны 239
ммк в кювете, толщиной слоя 1 см (в контрольную кювету помещают метиловыи спирт).
0,02—0,05 г преднизона растворяют
в 70—80 мл метанола, раствор разбавляют метанолом до 100 мл. 5 мл данного раствора
разбавляют метанолом до 100 мл и измеряют оптическую плотность, как указано выше.
Хранят с предосторожностью (список
Б), в хорошо закупоренных банках, в защищенном от света месте.
Применяют внутрь по 0,02—0,03
г в день, в виде порошка или таблеток по 0,001, 0,0025 и 0,005 г.
5.8 Преднизолон
Prednisolone. Преднизолон. Δ1-дегидрогидрокортизон.
11β,17α — 21-тригидроокси-Δ1,4-прегнандиен — 3,20-дион.
С19н28о5. М = 336,22.
Синонимы: Decortin Н, Metacortandrolon, Miticortelon,
Hydrocortancyl и др.

Открыт одновременно с предннзоном
(1955) и впервые синтезирован в 1955 г. Герцогом с сотрудниками (США). Ацетат преднизона
переводят в 3,20-дисемикарбазон и восстанавливают при С11 калийборгидридом.
Полученный таким путем преднизолон — 3,20-дисемикарбазон расщепляют азотистой кислотой,
образуется 21-ацетат преднизолона (с 5%-ным выходом). Лучшие выхода (10%) получены
дегидрированием гидрокортизона с помощью двуокиси селена, тетраацетата свинца и
микробиологическим путем с помощью Согупе bacterium simplex.
Преднизолон — белый кристаллический
порошок, т. пл. 240—241° (с разл.); его ацетат плавится при 237—239°(с разл.).
Применяют для тех же целей, что
и преднизон, в дозах 0,001, 0,0025, 0,005 г в таблетках.
5.9 Дексаметазон
Dexamethasonum. Дексаметазон. 16α-метил — 9α-фторпреднизолон.
9α-фтор — 11β,17а,21-тригидрокси-Δ1-прегнен — 3,20-дион. С21Н30О5.
М = 335,02.

Синонимы: Decadron, Dexadrol, Fortecortin.
Впервые получен Фридом и Сабо
в 1954 г. (США). Они исходили из 11-эпимера гидрокортизона (1), который получали
гидроксилированием вещества S Рейхштейна.
Ацетнлированием и тозилированием
был получен 21-ацетат — 11α-тозилат, который переводился в 17α-окси — 21-ацетокси-Δ4,9(11)-прегнадиен — 3,20-дион
(II). При взаимодействии с м-бромацетамидом в водном диоксане в присутствии хлорной
кислоты возникал 9-α-бромгидрокортизонацетат (III), который при действии ацетата
калия в этаноле превращался в 9β,11β-окись (IV). При взаимодействии последнего
с безводным фтористым водородом в хлороформе получался фторкортизонацетат (V) с
50%-ным выходом:

Гиршману с сотрудниками (1956)
удалось повысить выход на последней стадии до 75% при применении в качестве реакционной
среды органических оснований.
9β,11β-Эпоксид (IV)
является единственной ступенью синтеза Δ4,9(11)-прегнадиенового
производного микробиологическим путем с помощью Сurvulаrіа lаnаtа или Сunninghаmеllа blaкеslеаnа.
Дексаметазон — белый порошок,
т. пл. 260—262° (с разл.).
Применяют внутрь аналогично другим
кортикостероидам; препарат хорошо переносится в терапевтических дозах (0,5—1 мг),
относительно мало влияет на обмен электролитов и не вызывает задержки хлористого
натрия и воды в организме.
5.10 Определение подлинности препаратов
кортикостероидов
В испытаниях, рекомендуемых для
оценки качества кортикостероидов и их аналогов, много общего. При нагревании на
водяной бане смеси спиртового раствора кортикостероида и реактива Фелинга выпадает
красно-оранжевый осадок. Реакция обусловлена восстановительными свойствами а-кетольной
группировки, которая легко окисляется до карбоксильной:

В присутствии реактива Фелинга:

Восстанавливающие свойства а-кетольной
группы лежат в основе реакции «серебряного зеркала», которое образуют ряд кортикостероидов
(кортизона ацетат, гидрокортизон, преднизолон):

Кортикостероиды, содержащие а-кетольную
группу (кортизон и его аналоги), дают цветную реакцию, основанную на окислении 0,5%-ным
раствором хлорида трифенилтетразолия в этаноле в присутствии 10%-ного раствора гидроксида
тетраметиламмония. Появляется красная окраска, обусловленная образованием формазана:

Реакцию используют для фотоколориметрического
определения при длине волны 525 нм. Кортикостероиды можно отличить друг от друга
по реакции с концентрированной серной кислотой (табл.).
Таблица
2
Результаты взаимодействия кортикостероидов с концентрированной
серной кислотой
| Лекарственное вещество | Окраска раствора | Флуоресценция |
| Дезоксикортона ацетат | Желтая (после добавления воды — фиолетовая) Красная (после нагревания до 80-90°С) |
Зеленовато-желтая окраска с красной флуоресценцией (после добавления этанола) |
| Кортизона ацетат | Оранжевая (через 2 мин) | Желтая (через 5 мин в УФ-свете) |
| Гидрокортизон | Желтая, переходящая в красноватую (через 5 мин) | Желто-зеленая, переходящая в зеленую (после добавления воды) |
| Преднизолон | Зеленая, переходящая в красную | Отсутствует |
Известны и другие испытания на
отдельные кортикостероиды. Раствор кортизона ацетата в этаноле, выпаренный досуха
в вакууме, после нагревания до 70°С в течение 30 мин, с 1 М раствором гидроксида
натрия приобретает желтое окрашивание, имеющее интенсивное поглощение при 370 нм
(в отличие от преднизолона, который в тех же условиях приобретает лишь слабо-желтое
окрашивание).
Кортикостероиды можно отличать
друг от друга с помощью реакций на те или иные функциональные группы.
При нагревании на водяной бане
спиртовых растворов лекарственных веществ с раствором фенилгидразина появляется
желтое окрашивание. Реакция обусловлена образованием фенилгидразона (с кетонной
труппой в положении 3) и на примере кортизона ацетата происходит по схеме:

Для идентификации лекарственных
веществ, представляющих собой сложные эфиры, использована реакция получения ацетогидроксамовой
кислоты, которая затем с солями железа (III) образует соединения, окрашенные в темно-вишневый
(кортизона ацетат) или красно-коричневый (дезоксикортона ацетат) цвет:

Ацетильную группу можно обнаруживать
после гидролиза кортизона и гидрокортизона ацетатов в спиртовом растворе гидроксида
калия. Последующее прибавление концентрированной серной кислоты приводит к образованию
этилацетата, имеющего характерный запах. Эта реакция рекомендована ФС для испытания
на подлинность гидрокортизона ацетата:

Для качественного и количественного
анализа кортикостероидов и их аналогов используют спектрофотометрию
в УФ-области. Расчет содержания лекарственного вещества выполняют по удельному показателю
поглощения или (преднизолон) по оптической плотности ГСО. В табл. приведены условия,
в которых ФС рекомендуют выполнять испытания на подлинность и спектрофотометрическое
определение лекарственных веществ, производных кортикостероидов.
Таблица
3
Условия спектрофотометрического определения кортикостероидов
| Лекарственное вещество | Растворитель | Максимум поглощения, нм | Удельный показатель поглощения |
| Дезоксикортона ацетат | Этанол | 241 | 430-450 |
| Кортизона ацетат | Этанол | 238 | 390 І |
| Гидрокортизона ацетат | Этанол | 241 | 395 1 |
| Преднизолон | Метанол | 242 | 400-430 |
Для установления подлинности и
проведения испытаний на посторонние примеси ФС рекомендована также ИК-спектроскопия
и метод ТСХ. Так, для испытания подлинности преднизолона рекомендовано снимать ИК-спектр
в вазелиновом масле в области от 3700 до 400 см — 1 и сравнивать его с
прилагаемым к ФС рисунком спектра.
Методом ТСХ на пластинках Силуфол
УФ — 254 или Сорбфил устанавливают во всех лекарственных веществах наличие примесей
посторонних стероидов. На пластинку помимо испытуемого раствора наносят стандартные
образцы различных количеств стероидов, примеси которых обнаруживают. В состав подвижной
фазы входят метиленхлорид, метанол, хлороформ, вода в различных соотношениях. Обнаружение
пятен проводят в УФ-свете с длиной волны 254 и 365 нм. Проявителем может также служить
фосфорномолибденовая кислота. Суммарное содержание примесей не должно превышать
2-4%.
Идентифицировать и определить
содержание дезоксикортона ацетата спектрофотометрическим методом можно с помощью
реакции, основанной на взаимодействии с гидразином изатина. Оптическую плотность
образовавшегося гидразона измеряют в среде диоксана при длине волны 445 нм.
Методики фотоколориметрического
определения гидрокортизона ацетата и других 3-кетостероилов основаны на использовании
в качестве реактивов на кетогруппу при С — 3 стероидного цикла: фенилгидразина, 4-аминоантипирина,
изониазида, боргидрида натрия. Микроколоночную ВЭЖХ применяют для идентификации и испытаний
на чистоту ряда кортикостероидов: дезоксикортона ацетата, кортизона ацетата, преднизона
ацетата и преднизолона. Для анализа используют отечественный прибор «Миллихром»
с УФ-детектором при 238 нм. Количественное содержание примесей устанавливают методом
внутренней нормализации. Метод ВЭЖХ в прямофазном и обрашеннофазном вариантах использован
для количественного определения гидрокортизона ацетата и преднизолона в мазях. Для
анализа на прямой фазе используют смесь хлороформ-метанол (93:3), на обратной —
метанол. Лекарственные препараты кортикостероидов хранят по списку Б, в хорошо укупоренной
таре, предохраняя от действия света. Дезоксикортона ацетат, являющийся минералокортикостероидом,
применяют при болезни Аддисона, миастении, астении, общей мышечной слабости и других
заболеваниях. Вводят внутримышечно в виде масляных растворов от 0,005 г 3 раза в
неделю до 0,01 г ежедневно. Лекарственные препараты глюкокортикостероидов оказывают
противовоспалительное, десенсибилизирующее, антиаллергическое и антитоксическое
действие. Их применяют для лечения ревматизма, различных форм полиартрита, бронхиальной
астмы, кожных и различных аллергических заболеваний. Кортизона ацетат назначают
внутрь по 0,1-0,2 г в сутки, гидрокортизон — в виде 25%-ной суспензии в полость
суставов. Преднизалон по характеру действия аналогичен кортизону, но более активен.
Поэтому его высшие дозы: разовая — 0,015 г, суточная — 0,1 г (внутрь). Для местного
применения при глазных и кожных заболеваниях выпускают 0,5-1%-ные гидрокортизоновую
и 0,5%-ную преднизолоновую мазь. В результате исследования влияния галогенов, введенных
в молекулу кортикостероидов, на их фармакологическую активность были синтезированы
моно- и дифторпроизводные преднизолона. Они содержат в положении 9 один атом фтора—
дексаметазон (Dexamethasone), триамцинолон (Triamcinolone) или в положениях 6 и 9 два атома фтора
— флюметазона пивалат (Flumethasone Pivalate) и флюоцинолона
ацетонид (Fluocinolone Acetonide):

Введение атома фтора в положение
9а осуществляют действием фтороводорода, а образование двойной связи в положения
1-2 — микробиологическим путем. По физическим свойствам указанные лекарственные вещества
сходны с рассмотренными кортикостероидами. В основе способов их испытаний на подлинность-чистоту
и количественного определения лежат методы ИК- и УФ-спектрофотометрии, ТСХ, ВЭЖХ.
Широкие исследования в области стандартизации и создания новых лекарственных форм
синафлана, других коргикостероидов проведены на кафедре фармхимии Пятигорской фармацевтической
академии (М.В. Гаврилин). Фторпроизводные отличаются более активным чем У преднизолона,
противовоспалительным, антиаллергическим действием. Они высокоэффективны при местном
применении. Дексаметазон в 35 раз активнее кортизона. Дексаметазон назначают внутрь
до 0,002-0,003 г, а триамцинолон — до 0,01-0,02 г в сутки. Флюметазона пивалат и
флюоцинолона ацетонид применяют в виде 0,02-0,025%-ных мазей, кремов, эмульсий.
Выводы
Стероидные гормоны — группа физиологически активных веществ (половые гормоны,
кортикостероиды и др.), регулирующих процессы жизнедеятельности у животных и человека.
У позвоночных синтезируются из холестерина в коре надпочечников, клетках Лейдига
семенников, в фолликулах и желтом теле яичников, а также в плаценте.
·
Гормоны коркового слоя надпочечников:
o Кортикостероиды:
— Кортизон,
— Гидрокортизон,
— Кортикостерон,
— Прегнан,
— Преднизолон.
·
Половые гормоны
o Андрогенные (мужские):
— Андростерон,
— Тестостерон,
— Метилтестостерон.
o Эстрогенные (женские):
— Эстрон (Фолликулин),
— Эстрадиол,
— Эстриол,
— Этинилэстрадиол.
Стероидные гормоны являются производными
ряда углеводородов, главным образом прегнана, андростана, эстрана:

Они сходны между собой по химической
структуре. Отличие от андростана состоит лишь в том, что прегнан имеет в молекуле
этильный радикал, а эстран — ароматическое ядро и у него отсутствует одна из метальных
групп.
Структурной основой стероидных
гормонов является гидрированный скелет углеводорода циклопентанпергидрофенантрена:

Метильные группы, присоединенные
к стероидному циклу в положениях 10 и 13, называются ангулярными. Радикал R и атомы водорода (в положениях 8, 9,
14) ориентированы в пространстве в цис- или транс-положении. Условно принято считать,
что ангулярные метильные группы расположены над плоскостью чертежа (это обозначают
сплошной линией). Если другие заместители находятся в цис-положении, т. е. в одной
плоскости с ангулярными группами (Р-конфигурация), то их также обозначают сплошной
линией, а если в транс-положении (а-конфигурация), то пунктирной линией.
К числу производных прегнана относятся
кортикостероиды и гестагенные гормоны, производными андростана являются андрогенные
гормоны, а эстрана — эстрогенные гормоны.
Исходя из представленной
общей формулы и функциональных групп (заместителей), указанных в табл., можно написать
химические формулы каждой группы стероидных гормонов.
| Группа гормонов |
Двойная связь |
Заместители | ||
|
X1
|
Х2
|
R | ||
| Кортикостероиды |
ен — 4 диен 1,4
|
=О |
-Н -ОН =О
|
-СО-СН2ОН -ОН
|
| Гестагены | ен — 4 | =О | -Н |
-СО-СН3
|
| Андрогены | ен — 4 | =О | -Н | -ОН |
| Эстрогены |
триен — 1,3,5 (нет С — 19)
|
-ОН | -Н |
-ОН =О
|
Имеющие стероидную структуру полусинтетические
аналоги указанных групп стероидных гормонов содержат в своих молекулах ряд других
атомов и функциональных групп.
Стероидный цикл, указанные функциональные
группы влияют на физико-химические свойства гормонов и их аналогов. На использовании
этих свойств основаны способы испытаний на подлинность, количественное определение,
установлены условия хранения и стабильность лекарственных веществ, имеющих стероидную
структуру.
При испытании на подлинность для
подтверждения стероидного цикла в молекулах широко используют реакцию образования
окрашенных и флуоресцирующих веществ при действии концентрированной серной кислотой.
а-Кетольную группу открывают за счет проявления восстановительных свойств Кетогруппу
обнаруживают реакцией образования ке- токсимов при взаимодействии с гидроксиламином,
а также гидразонов — с фенилгидразином и другими гидразинами и гидразидами. Наличие
спиртового и фенольного гидроксилов в молекулах подтверждают реакцией этерификации
с последующим установлением температуры плавления образующихся эфиров, а наличие
сложноэфирных групп (в ацетатах, пропионатах, энантатах и др.) — либо по образованию
окрашенных солей гидроксамовых кислот, либо реакциями гидролиза в щелочной или кислой
среде. При наличии фенольного гидроксила в молекуле (природные и синтетические эстрогены)
используют также реакции галогенирования и образования азосоединений. Ряд перечисленных
химических реакций применяют для количественного определения стероидных гормонов
и их аналогов титриметрическими или фотоколориметрическим методами. Испытания на
подлинность и количественное определение выполняют также методом УФ-спектрофотометрии.
Список использованной литературы
1.
Арзамасцев А.П. Фармакопейный анализ
– М.: Медицина, 1971.
2.
Беликов В.Г. Фармацевтическая химия.
В 2 частях. Часть 1. Общая фармацевтическая химия: Учеб. для фармац. ин-тов и фак.
мед. ин-тов. — М.: Высш. шк., 1993. — 432 с.
3.
Глущенко Н.Н. Фармацевтическая химия:
Учебник для студ. сред. проф. учеб. заведений / Н.Н. Глущенко, Т.В. Плетенева, В.А.
Попков; Под ред. Т.В. Плетеневой. — М.: Издательский центр «Академия», 2004. — 384
с.
4.
Драго Р. Физические методы в химии
– М.: Мир, 1981
5.
Кольтгоф И.М., Стенгер В.А. Объемный
анализ В 2 томах – М.: Государственное научно-техническое издательство химической
литературы, 1950
6.
Коренман И.М. Фотометрический анализ
– М.: Химия, 1970
7.
Коростелев П.П, Фотометрический и комплексометрический
анализ в металлургии – М.: Металлургия, 1984, 272 с.
8.
Логинова Н.В., Полозов Г.И. Введение
в фармацевтическую химию: Учеб. пособие – Мн.: БГУ, 2003. — 250 с.
9. Мелентьева Г.А., Антонова Л.А. Фармацевтическая химия. — М.:
Медицина, 1985.— 480 с.
10. Мискнджьян С.П. Кравченюк Л.П. Полярография лекарственных
препаратов. – К.: Вища школа, 1976. 232 с
11. Фармацевтическая химия: Учеб. пособие / Под ред. Л.П. Арзамасцева.
– М.: ГЭОТАР-МЕД, 2004. — 640 с.
12. Фармацевтический анализ лекарственных средств / Под общей
редакцией В.А. Шаповаловой – Харьков: ИМП «Рубикон», 1995
13. Фармацевтичний аналіз: Навч. посіб. для студ. вищ. фармац.
навч. закл. III—IV рівнів акредитації/ П.О. Безуглий, В.О. Грудько, С.Г.
Леонова та ін.; За ред. П.О. Безуглого,— X.: Вид-во НФАУ; Золоті сторінки, 2001.—
240 с.