ГОУ ВПО
УРАЛЬСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Кафедра
хирургических болезней стоматологического факультета
Курсовая
работа
«Консервативное
лечение тромбоза глубоких вен нижних конечностей»
2010 год.
Введение
Острый тромбоз глубоких вен нижних
конечностей – прижизненное образование сгустков крови (тромбов) в просвете
глубоких вен нижних конечностей, довольно распространенное заболевание,
наблюдаемое как в амбулатории, так и в стационарах. Главная опасность этого
заболеваний – тромбоэмболия легочных артерий, которая возникает у 25–37%
больных. Установлено, что тромбоз глубоких вен редко встречается у абсолютно
здоровых людей. За последние десятилетие отмечается увеличение числа тромбозов
за счет увеличения числа операций, расширением показаний к их выполнению,
применение общего наркоза с миорелаксантами, увеличение доли пожилых пациентов
с выраженной сопутствующей патологией. Именно за счет этого изучение,
разработка и внедрение в практику методов консервативного лечения тромбоза
глубоких вен нижних конечностей является одной из важнейших задач в сосудистой
хирургии. Целью данной курсовой работы является рассмотрение основных методов
консервативного лечения, сравнение результатов лечения препаратами разных групп
и механизмов действия, будут рассмотрены различные варианты комбинации
препаратов, позволяющие наиболее эффективно лечить тромбоз глубоких вен,
результаты которого позволят избежать оперативного лечения, что немаловажно
особенно для пациентов пожилого возраста, составляющих основную массу из общего
числа страдающих вышеозначенным заболеванием.
1. Этиология и патогенез
возникновения тромбоза глубоких вен нижних конечностей
1.1 Факторы риска и
причины возникновения тромбоза глубоких вен нижних конечностей
В развитии острого
венозного тромбоза наиболее частыми факторами риска являются:
1. Возраст: После 40 лет
через каждые 10 лет риск тромботических осложнений удваивается. По данным Р. Hansson
(1997г.), частота венозных тромбозов у мужчин составляет 0,5% в возрасте до 50
лет; 0,9% – 54 года; 1,3% – 60 лет; 2% – 67 лет; 4,5% – 75 лет и 3,8% – 80 лет.
Это происходит в связи со склерозом венозной стенки и стазом крови в глубоких
венах. Рецидив венозных тромбозов в течение 12 месяцев по данным различных
авторов составляет от 4% до 27 (8,9)
2. Операция: Характер,
травматичность и продолжительность хирургических операций особенно в зоне
венозных сплетений и крупных вен играют основную роль. Травма тканей,
кровопотеря, нарушение микроциркуляции, стресс, длительный наркоз с релаксацией
мышц приводят к активации тканевых факторов свертывания крови, выбросу большого
количества тромбопластина, активации внутрисосудистых факторов свертывания,
уменьшению активаторов плазминогена и снижению фибринолитической активности
крови. С другой стороны, релаксация мышц при эндотрахеальном наркозе приводит к
стазу крови. С учетом этих факторов опасность тромботических осложнений
удваивается с каждым часом операции.
3. Переломы костей нижних
конечностей: Политравма и иммобилизация часто вызывают тромбоз глубоких вен.
Так, при переломах костей голени тромбоз глубоких магистральных вен и их
притоков наблюдается у 60–70% пострадавших. Поступление большого количества
тромбопластина из размозженных и травмированных мышц и тканей, нарушение оттока
из-за гематомы и отсутствие мышечных сокращений, замедление кровотока и стаз
при длительной иммобилизации способствуют развитию тромбоза в венозном русле.
4. Варикозное расширение
вен нижних конечностей: Возникновение тромбоза в варикозно расширенных венах называется
варикотромбофлебитом. Это самая распространенная форма тромбофлебита подкожных
вен. При варикозном расширении вен имеются все условия для развития тромбоза:
изменение сосудистой стенки, замедление кровотока, деформация и расширение,
несостоятельность клапанов, турбулентность кровотока, легкая ранимость,
статические перегрузки приводят к развитию флебита, тромбофлебита и
перифлебита, которые носят асептический характер. Восходящий тромбофлебит еще
одна причина возникновения тромбоза глубоких вен.
5. Ожирение: Достоверно
установлено, что у больных ожирением чаще развиваются тромбоэмболические
осложнения, при III–IV степени ожирения после 40 лет их риск увеличивается в 5
раз.
6. Наличие онкологических
(злокачественных) новообразований: Склонность к внутрисосудистому
тромбообразованию известна давно. Еще в 1865 г. Trouseau описал мигрирующий тромбофлебит у больного злокачественной опухолью. Тромбоз глубоких вен
(флеботромбоз) без особой на то причины является поводом для обследования
больного на наличие злокачественной опухоли. Наиболее часто флеботромбоз
возникает при аденокарциномах, которые продуцируют муцин (опухоли поджелудочной
железы, легких, желудка, толстой кишки, яичников). Кроме того, флеботромбоз
часто возникает при опухолях головного мозга, лейкемии, миеломной болезни. Риск
тромбоза и тромбоэмболии у онкологических больных после операции в 2–3 раза
больше, чем у общехирургических больных при аналогичных операциях.
7. Длительный постельный
режим: особенно при нарушении мозгового кровообращения, политравме, ожогах,
после длительных операций является частой причиной тромбообразования в венах
нижних конечностей.
8. Недостаточность
кровообращения II–III степени с отеками конечностей и гипокинезия.
9. Антифосфолипидный синдром:
В основе этой болезни лежит выработка антител (IgG и IgM) к фосфолипидам:
фосфатидилсерину и кардиолипину. Выраженная гиперкоагуляция при этом синдроме
приводит к образованию тромбов как в артериальной, так и в венозной системе.
10. Беременность и роды:
Длительная статическая нагрузка, физиологическая дилатация вен нижних
конечностей и таза с изменением гемодинамики, особенно на фоне уже имеющейся
патологии вен, представляют большую угрозу развитию тромбоза и эмболии легочной
артерии. Частота летальных исходов при родах и после них от тромбоэмболии
легочной артерии составляет 1–3 на 100 000 родов (M. Toglia и соавт., 1996).
11. Терапия эстрогенами
(прием противозачаточных лекарств).
12. Гиперкоагуляционные
синдромы: коагулопатии, характеризующиеся определенными клиническими и
преимущественно лабораторными признаками повышенного (ускоренного) свертывания
крови при отсутствии образования тромбов. При этом не наблюдается образования
тромбов ни в артериальной, ни в венозной системе, ни в микроциркуляторном
русле. Однако при этом регистрируется состояние повышенной готовности
циркулирующей крови к свертыванию. В условиях дисбаланса противосвертывающей
системы механизмы свертывания крови активируются и происходит
тромбообразование, в случае образования тромба в системе глубоких вен нижних
конечностей возникает их тромбоз.
13. Травмы сосудов
(бытовые, производственные, дорожно-транспортные, огнестрельные).
14. Сопутствующие
заболевания (ишемическая болезнь сердца, эндартериит, васкулиты, системные
аутоиммунные заболевания).
15. Переохлаждение,
перепады температуры, обезвоживание.
16. Временное нарушение
адекватного кровотока в сосудах (длительные путешествия, неудобное положение
нижних конечностей при длительной езде, полетах на самолете).
17. Вирусные и бактериальные
инфекции, которые часто приводят к повреждению эндотелия токсинами.
18. Тромбозы вен в
анамнезе.
В некоторых случаях
тромбозы глубоких вен проходят без острых клинических проявлений, а только
через 10–15 лет развиваются симптомы посттромбофлебитического синдрома.
Часто больные с тромбозом
глубоких вен не могут указать причину, которая привела к этому состоянию, и
недоумевают, как на фоне общего благополучия могла возникнуть болезнь. Если
более длительно проследить образ жизни пациента до заболевания, то в
большинстве случаев можно выяснить довольно существенные погрешности в питании,
режиме дня, небольшие травмы и неудобные положения тела, которые прошли для
больного незаметно, но способствовали развитию заболевания.
Острому глубокому тромбозу
очень часто предшествуют: острые респираторные заболевания дыхательных путей, тонзиллиты,
аллергические состояния, переохлаждения, злоупотребление жирной пищей,
алкоголем, никотином.
Особенно подвержены
острому тромбозу глубоких вен лица пожилого и старческого возраста с
атеросклеротическими поражениями артерий, недостаточностью кровообращения,
другими хроническими и аллергическими заболеваниями.
1.2 Механизм
возникновения и развития тромбоза глубоких вен нижних конечностей
Венозный тромбоз может
развиться при нормальной эндотелиальной выстилке сосуда. Формирование венозных
тромбов в большинстве случаев начинается на клапанах глубоких вен голени – в
венозных синусах мышц голени и в области клапанных створок вен (в венозных
пазухах). В этих местах аккумулируются активированные факторы свертывания
крови. Это связано с вихревым движением крови в области створок клапанов и в
местах деления вен.
Тромбоциты играют важную
роль в ранней фазе тромбообразования – они оседают на клапанах глубоких вен
голени или в местах с нарушенной целостностью эндотелия. Вначале происходит
адгезия тромбоцитов к эндотелию или к обнаженному коллагеновому слою венозной
стенки. Затем возникает агрегация тромбоцитов, высвобождение тканевого
тромбопластина и образуется красный тромб, который состоит помимо тромбоцитов и
фибрина, преимущественно, из эритроцитов. Этот красный тромб имеет тенденцию к
ретракции и может подвергаться асептическому лизису.
Дальнейшая судьба венозного
тромба зависит от одновременно протекающих конкурирующих процессов: коагуляции
и фибринолиза. С одной стороны, при преобладании фибринолиза тромб может
подвергнуться лизису в течение нескольких дней из-за действия фибринолизина,
который обычно находится в тромбе, в венозной стенке и в плазме. В этой фазе
большая часть тромба может быть разрушена, наступить его фрагментация, смещение
и миграция в легочные артерии. В то же самое время медленно нарастающий
воспалительный процесс в стенке вены и вокруг нее сопровождается
фибропластической организацией тромба. Дальнейшая судьба тромба варьирует от
полного его рассасывания без поражения структуры венозной стенки, когда область
его прикрепления и величина небольшие и фибринолиз активный, до его замещения
соединительной тканью (организация) при значительных размерах тромба и протяженной
области прикрепления к стенке сосуда при наличии слабого фибринолиза.
Организовавшийся тромб в течение нескольких недель реканализируется с
формированием множественных узких каналов. Вследствие организации тромба
происходит разрушение створок венозных клапанов, так как тромбоз изначально
развивается в области венозных пазух.
Тромбоз может
остановиться на определенном уровне вены или нарастать либо по току крови, либо
в ретроградном направлении.
Следует отметить, что при
тромбозе варикозно расширенных поверхностных вен может произойти
прогрессирование тромбо-образования в неизмененную общую бедренную вену с
образова-нием флотирующего тромба. В случае выраженного расширения перфорантных
вен при варикозной болезни нижних конечностей при наличии конгломерата
варикозных узлов на голени может произойти распространение тромбоза на эти
перфорантные вены и далее, на глубокие вены пораженного сегмента нижней конечности.
При тромбозе глубоких вен
голени он распространяется в проксимальном направлении на подколенную и
бедренную вены до крупного притока, являющегося функционально значимой
коллатералью. При этом интенсивный сброс крови из этого сосуда может прервать
восходящий тромбоз. При тромбозе внутренних подвздошных вен процесс
тромбообразования распространяется на общие и наружные подвздошные вены. При
тромбозе вен таза тромбообразование может распространяться в дистальном
направлении – в бедренные вены. Тромбоз может наступить в любом сегменте вены –
изолированно или сразу в двух местах независимо или же распространяясь по
продолжению.
По частоте развития
нетравматических тромбозов глубоких вен нижних конечностей на первом месте
стоит тромбоз мышечных вен голени (85-90%), затем общая подвздошная вена и
притоки внутренней подвздошной вены (от 10-15 до 49%) и на третьем месте по
частоте стоят подколенная и бедренная вены (5 %).
2. Клинические проявления тромбоза глубоких вен нижних конечностей
Тромбоз глубоких вен. Клиническая картина
при остром тромбозе глубоких вен определяется внезапно возникшим нарушением
венозного оттока при сохраненном притоке артериальной крови. Основные симптомы
1. Острая распирающая боль в области
икроножных мышц.
2. Отек мышц стопы и голени.
3. Цианоз кожи.
4. Переполнение подкожных вен стопы.
5. Повышение локальной температуры.
6. Боли по ходу сосудистого пучка.
7. Усиление боли при тыльном сгибании стопы
из-за натяжения икроножных мышц и сдавления вен (симптом Хоманса).
8. Симптом Мозеса – болезненность голени при
переднезаднем сдавлении.
9. Симптом Ловенберга – боли в икроножных
мышцах при давлении манжетки сфигмоманометра до 150 мм рт. ст.
При тромбозе подколенной вены увеличивается
объем всей голени на 3–4 см и более, при тромбозе бедренной вены клиническая
картина проявляется более ярко и отмечается отек не только на стопе и голени,
но и на бедре. Здесь же отмечаются болезненность по ходу сосудистого пучка.
Кроме этих локальных симптомов наблюдаются общие симптомы асептического
воспаления:
1) умеренное повышение температуры,
2) лейкоцитоз,
3) адинамия,
4) слабость.
Клиническая картина при поверхностном и
глубоком тромбозе вен во многом зависит от протяженности тромботического
процесса, скорости образования, степени и быстроты распространения в дистальном
и особенно в проксимальном направлении.
Самым опасным при тромбозе глубоких вен и тромбофлебите
подкожных вен является восходящий характер процесса, т.е. когда тромботический
процесс распространяется из дистальных отделов в проксимальные, что реально
угрожает тромбоэмболией легочной артерии. Ситуация усугубляется тем, что у
значительного числа больных при восходящем тромбофлебите подкожных вен верхушка
тромба располагается на 10–15 см проксимальнее пальпируемого тяжа и
инфильтрата.
Наиболее опасны «флотирующие»
тромбы, когда дистальная часть тромба фиксирована к венозной стенке, а проксимальная
– свободно свисает в просвет вены, где фиксация тромба в этих случаях слабая.
Достаточно небольшие колебательные движения, усиление скорости кровотока в
венах, неловкое движение, вставание с постели, вызывают отрыв тромба и эмболию
легочной артерии. Такие тромбы, по В.С.Савельеву и А.И.Кириенко, называются
эмбологенными.
Полиморфизм клинических проявлений ТГВ часто
требует проведения дифференциального диагноза с заболеваниями, протекающими со
сходной симптоматикой (межмышечные гематомы, миозиты, растяжения мышц, травмы ахиллова
сухожилия, артрозы, артриты и др.). В связи с этим возникает необходимость
привлечения дополнительных, инструментальных методов обследования.
тромбоз хирургический
вена терапия
3. Методы и виды диагностики
тромбоза глубоких вен нижних конечностей
Основное место в
диагностике тромботического процесса в венозной системе наряду с клинической
картиной занимают ультразвуковые методы диагностики.
I. Ультразвуковая допплерография – самый
распространенный метод, который позволяет достаточно четко выявить тромбоз и
его локализацию. Однако этот метод не позволяет достоверно установить
протяженность тромботического процесса, характер кровотока и состояние венозной
стенки, особенно глубоких вен.
II. Дуплексное ангиосканирование –
наиболее точный и высокоинформативный метод в диагностике венозного тромбоза.
Ангиосканирование позволяет верно оценить состояние венозной стенки и просвета,
установить характер тромбоза (пристеночный или полный), определить дистальную и
проксимальную границу тромба, оценить проходимость перфорантных вен и судить о
выраженности воспалительной инфильтрации окружающих тканей (перифлебит).
Ультразвуковое дуплексное сканирование, проводимое при диагностике, позволяет
выбрать наиболее верную тактику лечения в каждом конкретном случае.
III.
Рентгеноконтрастная
флебография при тромботическом процессе в венах дистальнее паховой складки
применяется исключительно редко. При наличии тромботического процесса в
подвздошных венах и нижней полой вене выполняется ретроградная илеокаваграфия,
что позволяет четко определить проксимальную границу тромба, его характер,
эмбологенность и выбрать тактику дальнейшего лечения. При флотирующем характере
тромба диагностическая процедура сразу же должна перейти в лечебную в плане
имплантации кава-фильтра. Если это невозможно, то хирурги прибегают к
экстренным операциям, препятствующим отрыву тромба и эмболии легочной артерии.
IV.
Импедансная
плетизмография. После ослабления манжеты, сдавливавшей голень с силой,
достаточной для временной окклюзии вен, определяют изменение объема
кровенаполнения голени. Проба позволяет диагностировать глубокий венозный
тромбоз выше уровня колена с точностью до 90%.
4. Лечебная тактика
4.1 Задачи проводимого
лечения
При лечении острого
венозного тромбоза глубоких вен нижних конечностей хирурги должны решать
несколько задач:
1. Препятствовать
прогрессированию тромбоза.
2. Предотвратить
тромбоэмболию легочной артерии.
3. Не допустить
прогрессирование отека и тем самым предотвратить развитие венозной гангрены и
потерю конечности.
4. Способствовать быстрой
реканализации и достижению компенсации венозного оттока.
4. Провести профилактику
посттромбофлебитического синдрома.
5. Предотвратить
ретромбоз.
В решении этих задач
важное значение имеют:
1. Режим физической
активности.
2. Правильная и
длительная эластическая компрессия.
3. Эффективность
фармакотерапии.
4. Своевременное
хирургическое лечение.
5. Квалифицированная
реабилитация.
Ведущим методом лечения тромбоза
глубоких вен бедра и голени является консервативная терапия, для чего больной с
острым тромботическим процессом в венозном русле должен быть срочно
госпитализирован в отделение сосудистой или общей хирургии. Больного с острым
венозным тромбозом изначально необходимо расценивать как кандидата на
тромбоэмболию легочной артерии.
4.2 Режим ведения больных
При тромбозе глубоких вен
голени, бедра и подвздошных вен первые 3–5 суток до снятия венозной гипертензии
и инструментального обследования на предмет характера тромбоза (локализация,
эмболоопасность) рекомендуется постельный режим.
При отсутствии флотации и
эмбологенности больным разрешают активный образ жизни с правильной эластической
компрессией всей конечности до паховой складки.
В тех случаях, когда нет возможности
провести полноценное обследование (ультразвуковое сканирование), больные должны
находиться на постельном режиме 7–10 суток на фоне антикоагулянтной и
компрессионной терапии. Это время достаточно для снятия угрозы тромбоэмболии
легочной артерии и фиксации тромба к венозной стенке, и больным разрешают вставать,
дозированно ходить по палате, активно сгибать и разгибать стопы и пальцы для
ускорения потока крови, то есть пациентам рекомендуют двигательный режим с
ограничением статического пребывания в вертикальном положении.
Во-первых, физические упражнения
способствуют компенсации деятельности сердечно-сосудистой системы вообще и
венозного оттока из конечностей в частности.
Во-вторых, сокращение мышц обеспечивает рост
концентрации важного антитромботического фактора – тканевого плазминогена.
В период постельного режима и особенно при
имеющемся отеке конечности следует поднять нижний конец кровати для улучшения
венозного оттока.
После перенесенного тромбоза глубоких
необходимо постепенно расширять объем физических упражнений. Специальная
гимнастика в горизонтальном положении благоприятно сказывается на реабилитации
больных. Необходимо исключить лишь те ее виды, где присутствует статический
компонент или которые могут провоцировать травмы ног. Кроме этого, все
упражнения следует выполнять в условиях эластической компрессии нижних
конечностей.
Наращивание нагрузки должно происходить
постепенно.
Для начала достаточно ежедневной 1,5-часовой прогулки с периодическим отдыхом.
Если пораженная конечность не реагирует болевым или судорожным синдромом,
продолжительность и кратность прогулок может быть увеличена. Через 2 – 3 месяц
физические упражнения можно расширить за счет гимнастики, направленной на
улучшение венозного оттока из конечности. Это упражнения в положении лежа на
спине с приподнятыми ногами («березка», «ножницы», «велосипед» и др.). В
дальнейшем могут быть подключены упражнения на велотренажере, бег трусцой,
беговые лыжи. Кроме этого, на всех этапах реабилитации целесообразно занятие
плаванием, которое является оптимальным видом спорта для больных с патологией
венозной системы.
4.3 Компрессионная терапия
Всем больным с тромбозом глубоких вен в
обязательном порядке необходимо проводить эластическую компрессию всей нижней
конечности. С помощью эластических бинтов проводится адекватная компрессия от
стопы до паховой складки.
Правила формирования компрессионного бандажа
из бинтов:
1) повязку накладывают при тыльном сгибании
стопы. Это предупреждает образование складок в области лодыжек, так как складки
могут повредить кожу при движении;
2) повязка должна достигать проксимальных
суставов пальцев стопы и захватывать пятку;
3) давление бинта должно плавно ослабевать
от лодыжки в проксимальном направлении;
4) при наложении бандажа рулон бинта
раскручивают наружу, при этом он находится в непосредственной близости от
кожных покровов;
5) необходимо моделировать цилиндрический
профиль конечности путем наложения на плоские ее части (тыл стопы,
окололодыжечные ямки) поролоновых или латексных подушечек. Для предотвращения
пролежней кожи на участках ноги с малым радиусом (лодыжки, большеберцовая
кость) накладывают поролоновые или латексные прокладки;
6) наложение компрессионного бинта должно
соответствовать форме ноги, т. е. при конической форме туры бинта должны идти в
восходящем и нисходящем направлениях.
При правильно наложенном
компрессионном бандаже в покое кончики пальцев слегка синеют, а в начале ходьбы
восстанавливают свой обычный цвет.
Механизм действия
компрессионного лечения:
· Снижение патологической венозной
”емкости” нижних конечностей;
· Улучшение функциональной способности относительно
несостоятельного клапанного аппарата;
· Ускорение скорости венозного оттока;
· Возрастание обратного всасывания
тканевой жидкости в венозном колене капилляра и снижением ее фильтрации в
артериальном – за счет повышения тканевого давления. Результат регресс — отека;
· Увеличение фибринолитической
активности крови за счет более интенсивной выработки тканевого активатора
плазминогена.
Эффективность
эластической компрессии повышается, если кожу на месте тромботического процесса
обильно смазывать активными флеботропными мазями (лиотон-гель), а также
содержащие НПВП (индавазин и др).
4.4 Лечение нестероидными
противовоспалительными средствами (НПВП)
Важным компонентом в
лечение тромбоза глубоких вен является применение НПВП.
Механизм действия:
· Подавление синтеза ПГ, цитокинов и
лейкотриенов;
· Блокирование образования супероксидных
радикалов;
· Препятствие высвобождению лизосомальных
ферментов;
· Стабилизация клеточных мембран;
· Снижение агрегации и адгезии нейтрофилов;
· Стимуляция функций лейкоцитов.
Резюмируя широкий спектр
фармакологический реакций, индуцируемых НПВП, можно определить клинические
эффекты, которые могут быть достигнуты при их рациональном применении:
противовоспалительный, гипоадгезивный, дезагрегантный, обезболивающий и
антипиретический.
НПВП назначают по
короткой и длинной схеме. Короткая схема заключается в применении этих средств
внутримышечно и/ или в свечах 2-3 раза в сутки в сочетании с топическими
формами (мази и гели) 3-4 раза в день в течении 5-7 суток, используется для
быстрого купирования симптомов глубокого тромбоза или в целях
послеоперационного обезболивания. Длину схему применяют при пролонгированном
лечении острого венозного тромбоза, посттромбофлебитической болезни,
профилактики варикотромбофлебита. В этих случаях начинают с того же режима
терапии, но через 7 дней переходят на пероральный прием гастропротективных форм
НПВП 1-2 раза в сутки в сочетании с топическими их формами 3-4 раза в день на
срок 2-3 недели.
4.5 Применение флеботоников
В лечение тромбоза
глубоких вен допустимо применение флеботоников, таких как Детралекс, как в
острый период, так и в восстановительном периоде, доказано, что данный препарат
уменьшает болевой и отечный синдром.
Как показали результаты многоцентровых
рандомизированных контролируемых плацебо исследований по изучению механизма
действия микронизированного диосмина, препарат Детралекс увеличивает венозный
тонус и лимфоотток, уменьшает повышенную проницаемость и повышает
резистентность капилляров. Кроме того, последние экспериментальные исследования
продемонстрировали уменьшение взаимодействия лейкоцитов и эндотелия в условиях
ишемии-реперфузии. Детралекс уменьшает адгезию нейтрофилов в посткапиллярных
венулах. В других экспериментальных исследованиях по изучению микроциркуляции
показано, что микронизированный диосмин достоверно ингибирует адгезию и
миграцию лейкоцитов в условиях ишемии-реперфузии, что свидетельствует о
защитном влиянии препарата на ткани. Исследование с использованием декстрана,
меченного флуоресцин-изотиоцианатом, в котором при изучении микроциркуляции
использовались топические аппликации гистамина, брадикинина и лейкотриена В4 с
целью нарушения микроциркуляции и усиления пропотевания форменных элементов
крови через сосудистую стенку, показало, что предварительное лечение
Детралексом позволяет избежать повреждающего действия проинфламаторных
медиаторов на микроциркуляцию. Влияние препарата на микроциркуляцию изучалось с
использованием лазерной допплеровской флуометрии. После трех месяцев лечения
наблюдалось повышение парциального давления кислорода в тканях ТcPO2, и
уменьшалось ТcPCO2.
4.6 Антикоагулянтная терапия
4.6.1 Антикоагулянты прямого действия
В первые часы госпитализации больных острым
тромбозом глубоких вен бедра и голени, а также при тромбозе подвздошных вен
(илеофеморальный тромбоз) назначают антикоагулянты прямого действия с
последующим применением непрямых антикоагулянтов (фенилин, варфарин и др.),
которые способствуют прекращению роста и распространения тромба.
Антикоагулянтная терапия назначается в
качестве основного метода лечения острых распространенных тромбозов глубоких
вен нижних конечностей и таза, а также при невозможности проведения и наличии
явных противопоказаний к оперативному способу дезоблитерации сосудов, либо при
продолжительности тромбоза более 20 суток. Антикоагулянтная терапия
целесообразно использовать в качестве завершающего этапа тромболитической
терапии и хирургической тромбэктомии.
В настоящее время наиболее оптимальным
методом лечения больных с ТГВ признана внутривенная гепаринотерапия, однако
из-за отсутствия адекватного лабораторного контроля за уровнем гипокоагуляции в
большинстве лечебных учреждений, гепарин вводят подкожно дробно в сочетании с
другими антитромботическими препаратами, что значительно увеличивает стоимость
лечения.(4,10)
При отсутствии противопоказаний обычный
(нефракционированный) гепарин назначают в суточной дозе 450 ЕД на 1 кг массы
тела пациента. В зависимости от пути введения рассчитывают однократную дозу
путем деления суточной дозы на количество инъекций (8 инъекций при
внутривенном, дробном введении с интервалом в 3 ч; 3 – при подкожном введении с
периодичностью 8 ч). Для достижения максимально быстрого антикоагуляционного
эффекта целесообразно первоначальное внутривенное введение 5000 ЕД гепарина
струйно, а затем остаток суточной дозы с помощью инфузомата.
По данным различных авторов длительность
применения нефракционированного гепарина при ТГВ колеблется от 5 до 20 суток.
При этом дозу гепарина следует корригировать
с учетом временных показателей свертывания крови (АЧТВ) (оптимально их
удлинение в 1,5 – 2 раза от нормы), которые ежедневно оценивают перед очередным
введением препарата.
Некоторые авторы указывают на эффективность
применения реологических препаратов (реополиглюкин, трентал, никотиновая кислота,
аспирин и др.)
Отдельными клиническими исследованиями не
выявлено достоверных различий в лечении пациентов монотерапией (гепарины в
течение 5-7 дней с переходом на непрямые антикоагулянты на 3-6 сутки) и тех,
кто получал комплексную терапию (гепарины до 20 дней, реополиглюкин, трентал,
аспирин, никотиновая кислота, с последующим переходом на непрямые
антикоагулянты).
Выявлено что при длительном применении
гепарина имеет место тромбоцитопения, как первичная, так и вторичная, а также снижение
показателей антитромбина III к 5-7 суткам. Отсюда вытекает, что курс
гепаринотерапии в течение 5-7 суток предотвращает ретромбоз и экономит
материальные средства лечебных учреждении.
В настоящее время для антикоагулянтной
терапии ТГВ широко используют низкомолекулярные гепарины (НМГ). Их селективное
преимущественно анти-Ха действие пролонгирует антитромботический эффект и
снижает частоту геморрагических осложнений. В международной практике наибольшее
распространение получил эноксапарин. Эноксапарин назначают в дозе 1 мг/кг 2
раза в сутки под кожу живота. Следует подчеркнуть, что при использовании НМГ
ежедневный лабораторный контроль за системой гемостаза необязателен, что
создает благоприятные предпосылки для амбулаторного лечения эмболонеопасных ТГВ.
При сравнении лечения нефракционированным
гепарином и НМГ выявлено преимущество последних за счет низкого процента
геморрагических осложнений, удобностью дозирования, в отсутствии необходимости
частого лабораторного контроля АЧТВ, возможным применением в амбулаторном
порядке, экономией средств лечебных учреждений.
Согласно современным взглядам лечения ТГВ
наиболее оптимальным является назначение НМГ, вместо нефракционированных
гепаринов, в течение 5 суток с последующим переходом на непрямые антикоагулянты.
4.6.2 Непрямые
антикоагулянты
4.6.2.1 Механизм действия и классификация
АНД
Механизм действия АНД
Антикоагуляционный эффект кумаринов
опосредован через ингибицию карбоксилирования от витамина К зависимых факторов
свертывания II, VII, IX. Это влияет на синтез иммунологически определяемых, но
биологически неактивных форм этих факторов свертывания. Кумарины также
ингибируют зависимое от витамина К карбоксилирование С и S протеинов.
Карбоксилирование зависимых от витамина К факторов свертывающей системы крови
катализирует карбоксилаза только в присутствии редуцированной формы витамина К
(витамин КН2), молекулярного кислорода и двуокиси углерода. В ходе этой реакции
витамин КН2 окисляется до эпоксида витамина К, который впоследствии
возвращается в витамин К эпоксидредуктазой витамина К. В дальнейшем цикле
витамин К снова превращается в форму витамина КН2 редуктазой витамина К. АНД
ингибируют оба фермента – редуктазу витамина К и эпоксидредуктазу витамина К.
Торможение или полная ингибиция этого
процесса обусловливают образование и синтез гемостатически неполноценных белков
системы свертывания крови: факторов II (протромбин), VII (проконвертин), IX
(антигемофильный глобулин В), X (Стюарта-Проуера), а также двух регуляторных
белков – протеина С и S. Протеин С циркулирует в виде проэнзима и активируется на
эндотелии комплексом тромбин тромбомодулин в активную форму. Активный протеин С
в присутствии протеина S, как кофактора, ингибирует активность фактора VIII и
фактора V. Таким образом, антагонисты витамина К вызывают биохимическое
несоответствие: во-первых, продуцируют антикоагулянтную активность через
ингибицию прокоагулянтов (факторы II, VII, IX, X), и, во-вторых, реализуют
потенциально тромбогенный эффект путем задержки синтеза естественных
ингибиторов свертывания (протеины С и S). Задерживая циклическую конверсию
витамина К, АНД обусловливают продукцию и секрецию печенью частично
карбоксилированных и декарбоксилированных, то есть функционально неполноценных
белков. Эти изменения приводят к искусственному нарушению начальных фаз
свертывания крови.
Выключение из схемы свертывания зависимых от
витамина К белков происходит с различной скоростью, что обусловлено временем их
обновления и синтеза, то есть от так называемого периода их полураспада.
Знание сроков и продолжительности
ингибирования факторов необходимо для понимания правильного ведения лечения АНД
(ввод в антикоагуляцию), при переходе на другие антикоагулянты или другие дозы
(поддержание антикоагуляции и защита от тромбообразования). Первым под влияние
антивитаминов К попадает фактор VII, и только позднее начинают снижаться
концентрации других факторов, чувствительных к кумаринам. Этим объясняется
возможность развития кратковременной гиперкоагуляции или иногда тромбоза в
период перехода от, например, гепаринов на АНД.
Антикоагуляционный эффект АНД появляется
только после их взаимодействия с факторами свертывания крови. Для этого
требуется определенный латентный период, который в зависимости от вида
препарата и его дозы может длиться 3-5 суток. В это время активно
контролируется доза препарата. После прекращения применения АНД, его действие
проявляется еще в течение 3-5 суток.
Необходимо обратить внимание, что АНД
проникают через плаценту. Поэтому их назначение, в особенности в течение
первого триместра беременности, может вызвать нежелательные побочные исходы.
АНД не растворяют образованных тромбов, но
статистически достоверно предупреждают образование новых тромбов. АНД действуют
как в артериальной, так и в венозной системе кровообращения.
Терапевтический эффект АНД начинает
проявляться через 24 часа, однако максимум действия наблюдается только на 2-5-й
день. Имеется прямая связь между дозой лекарства и выраженностью
антикоагуляции, но эта зависимость подвержена значительной индивидуальной
изменчивости.
Классификация АНД
В табл. 1 приведены известные в настоящее
время АНД, имеющие различное химическое строение и поэтому отличающиеся
неодинаковым фармакологическим и терапевтическим действием.
Таблица 1. Производные 2,4-гидроксикумарина и
индандиона-(1,3)
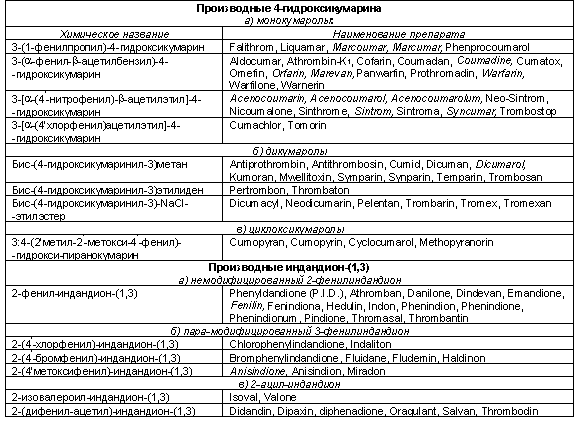
Примечание. Курсивом обозначены наиболее
популярные соединения
Наиболее часто используемыми в мире АНД
являются производные монокумаролов (4-гидрокискумарина), среди которых
преимущественной популярностью пользуется варфарин или его различные аналоги.
Основное качество данного препарата заключается в высокой прогнозируемости
терапевтического действия и высокой биопреемственности. Другие препараты
отличаются индивидуальными свойствами, поэтому их применение требует более
тщательного обоснования, контроля дозирования и слежения за ожидаемым
результатом.
4.6.2.2 Показания и противопоказания для
назначения АНД, их взаимодействие с другими лекарствами и системами органов
пациента.
Показания к применению АНД
Самостоятельно или в комплексе с другими
противотромботическими средствами АНД назначаются для:
·
профилактики
венозных тромбозов (особенно при высоком риске, когда имеется более одного
фактора риска развития тромбофилии, обусловливающей тромбоэмболию;
·
лечения венозных
тромбозов;
·
лечения острой
тромбоэмболии легочной артерии или ее рецидивов;
·
предупреждения
системной эмболизации при наличии: – биопротезного или механического клапана
сердца;
·
– болезни
венечных артерий (нестабильная грудная жаба, острый неосложненный инфаркт
миокарда, вторичное долгосрочное предупреждение возможной системной
тромбоэмболии, реваскуляризация);
·
– болезни
сердечных клапанов;
·
– мерцания/трепетания
предсердий;
·
– высокого риска
тромбоэмболии во время нормальной или осложненной беременности;
·
–
продолжительного постельного режима;
·
– угрозы или
развившегося тромбоза вен сетчатки глаза;
·
– тяжелой
сердечной недостаточности;
·
– ревматического
поражения сердца;
·
– артериальных
протезов;
·
– люпус
антикоагулянта и клинически видимых тромбозов;
·
предупреждения
идиопатического тромбоза и семейного предрасположения к нему;
·
предупреждения или
лечения тромбозов и окклюзий в артериальном кровотоке;
·
предупреждения
рецидивирующего и мигрирующего тромбофлебита;
·
предупреждения
тромбоза или эмболизации сосудов мозга, спазма сосудов мозга с симптомами интермиттирующей
недостаточности в бассейне сонной артерии;
Противопоказания к применению АНД
Общего характера: невозможна
интеллектуальная связь между больным и врачом (возникает опасность
передозировки или недостаточной дозы АНД), беременность (особенно первый
триместр, поскольку АНД проникают через плаценту, а также являются
тератогенными), кормление новорожденного (возможен геморрагический диатез
новорожденного, хотя прямых данных не имеется, однако риск прекращения приема
АНД при наличии высокого риска тромбоэмболии более опасен для матери),
психические расстройства, нежелание больного общаться с врачом, алкоголизм
(нарушения функции печени, затрудняющие метаболизм витамина К), нарушения диеты
или усвоения пищевых продуктов (возможно накопление антидотов АНД – витамина К
или потенциирующих АНД действие веществ), травмы и операции (опасность
кровотечения), гиповитаминоз К и С.
Сердечно-сосудистые заболевания: резистентная
артериальная гипертензия, диссекация аорты, перикардит, инфекционный эндокардит
(если имплантирован искусственный клапан сердца, то АНД назначаются, но
контроль состояния свертывания крови более строгий).
Болезни пищеварительного тракта: язвенная болезнь
желудка или двенадцатиперстной кишки, варикозные узлы в сосудах пищевода или
расширенные вены пищевода.
Патология печени: значительные
повреждения паренхимы печени. Гипербилирубинемия вытесняет АНД из комплекса с
белками крови, что затрудняет транспортировку АНД.
Патология почек: выраженная
недостаточность функции почек (уровень креатинина в крови больше 140 мкмоль/л).
Гематологическая патология: нарушения
свертываемости крови любого происхождения, гематологические системные
заболевания со скрытыми признаками геморрагического синдрома.
Центральная нервная система: ее заболевания,
нейрохирургические операции, нетромбоэмболический инсульт.
Некачественный лабораторный контроль влияния
антикоагулянтов на свертываемость крови (невозможна точная дозировка АНД и
контроль эффективности лечения).
Отсутствие антидотов для антикоагулянтов
(невозможна срочная помощь при кровотечениях в случаях передозировки АНД).
Недостаточное понимание больного необходимости
приема антикоагулянтов и самопроизвольное отклонение от предписания врача
(больному следует совершенно четко объяснить лечебную целесообразность приема
АНД и возможные осложнения, возникающие как вследствие действия самих АНД, так
и вследствие нарушения схемы приема АНД).
Недостаточные знания врача о фармакологическом
и биологическом действии антикоагулянтов (назначающий АНД врач обязан точно
знать показания и противопоказания к назначению АНД, схемы лечения и контроля,
осложнения и побочные явления, а также методы и средства скорой помощи при их
появлении).
Тактика врача, назначающего АНД, и
обязанности больного
Перед назначением АНД врач обязан:
·
обосновать
показания;
·
предупредить
больного о возможных осложнениях и побочных явлениях, их клинических признаках
и тактике поведения в острых ситуациях, объяснить, что АНД – не безопасное
лекарство, но абсолютно необходимое для предупреждения опасных для жизни
осложнений;
·
выяснить методику
определения необходимых показателей свертывания крови (протромбиновый индекс –
ПИ, протромбиновое время – ПВ или международный нормализованный индекс – МНИ) в
лечебном учреждении, где будет наблюдаться больной, и их нормы;
·
объяснить влияние
некоторых пищевых продуктов на уровень ПВ и ложные признаки передозировки АНД,
в том числе признаки ложной гематурии.
Врач также обязан
оценить:
·
исходное
состояние свертываемости крови больного по данным той лаборатории, где
впоследствии будет наблюдаться больной;
·
функцию печени;
·
возможность и
качество лабораторного контроля дозы АНД;
·
дозу АНД в
зависимости от клинической ситуации;
·
взаимодействие
АНД с другими принимаемыми больным лекарствами;
·
степень риска
тромбоэмболии или кровотечения, а также другие осложнения.
Планируя длительное
лечение АНД, необходимо уточнить, нет ли у больного асимптомной язвенной
болезни желудка или двенадцатиперстной кишки, а также других причин, которые
могут способствовать развитию кровотечения.
Обязанности больного, принимающего АНД:
1. Принимать лекарство строго в одно и
то же время суток (рекомендуется в 5-7 часов утра).
2. Пропущенная по каким-либо причинам
доза лекарства записывается в специальной ежедневной карте дозировок. Эта доза
должна быть принята в течение последующих 12 часов, после чего график приема
лекарства восстанавливается. Не допускается удвоение дозы препарата за счет
пропущенной.
3. Больной строго придерживается
рекомендаций врача по схеме лечения АНД, тщательно знакомится с информацией об
АНД, их лечебном действии и необходимости такого лечения, о взаимодействии с
другими принимаемыми лекарствами, побочными явлениями и признаками
передозировки, а также правилами первой помощи при угрозе развития
кровотечения, рекомендациями по диете.
4. Больной обязан информировать лечащего
врача об изменениях клинического состояния, возникших признаках или развившемся
кровотечении.
5. Необходимо информировать врача о
начале приема новых лекарств, о планировании беременности, об изменении
привычек питания.
6. Не принимать АНД одновременно с
аспирином или аспиринсодержащими препаратами, а при возникновении такой
необходимости проводить лечение под строгим контролем.
7. Если проводится интенсивное лечение
АНД, больному рекомендуется пользоваться электрической бритвой и осторожно
чистить зубы, чтобы не вызвать кровотечение.
Побочные явления во время
лечения АНД: Повышенная
индивидуальная чувствительность к АНД может вызвать быстрое снижение ПИ или
тромбопластинового (протромбинового) времени (ТВ);
·
тошнота;
·
рвота;
·
понос;
·
повышение
температуры;
·
дерматиты, некроз
кожи (АНД обусловленный некроз кожи обычно развивается в течение первых 3-8
дней лечения у большинства больных со сниженным уровнем протеина С, протеина S
или наличием фактора V Лейден из-за кратковременного гиперкоагуляционного
состояния и тромбоза подкожных венул и капилляров, когда принимаются высокие
дозы лекарства; поражения кожи обычно появляются на конечностях, груди,
туловище, половых органах);
·
лейкопения;
·
выпадение волос;
·
у детей может
развиться деминерализация костей (окончательно не доказано);
·
адренокортикальная
недостаточность;
·
желтуха;
·
повреждения
слизистой рта;
·
боли в пальцах
нижних конечностей (пурпурный цвет);
·
отеки;
·
острый
агранулоцитоз;
·
крапивница.
Действие АНД усиливают:
Эндогенные факторы: заболевания
щитовидной железы (гипотироидизм вызывает сниженный ответ на АНД,
гипертироидизм – повышение чувствительности к АНД), долгое пребывание при
высокой температуре, повышение температуры тела (снижается метаболизм АНД,
повышается клиренс зависимых от витамина К факторов свертывания),
недостаточность функции печени (в печени синтезируются многие факторы
свертывающей системы крови), коллагенозы, недостаточное питание
(гипоальбуминемия, недостаточное усвоение витамина К в тонком кишечнике),
сердечная недостаточность (повышение чувствительности к АНД из-за застойных
явлений в печени), стеаторея, недостаточность витамина К в диете, значительное
снижение массы тела.
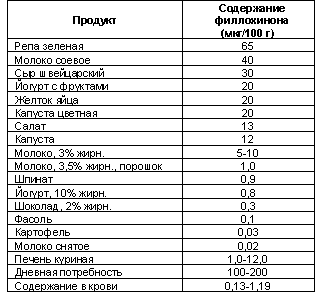
Действие АНД ослабляют:
Эндогенные факторы: врожденная
устойчивость к АНД, гиперлипидемия, гипотироидизм, обильное употребление
зеленых овощей, в которых много витамина К (помидоры, капуста, редиска, шпинат,
салат), лечебных трав (арника, тысячелистник обыкновенный, калина, барбарис,
щавель, лапчатка, рябина), рыбы или печени.
Таблица 2. Содержание витамина К2 (филлохинона)
в некоторых пищевых продуктах
Экзогенные факторы: адренокортикостероиды, алкоголь*, антацидные препараты, антигистаминные препараты, антиконвульсанты, барбитураты,
Carbamazepinum, Cholestyraminum, Chloralii hydras*, Colchicinum, Colestipolum, диуретики*, эстрогены,
Gemfibrozilum, Grizeofulvinum, Haloperidolum, Meprobamatum, пероральные противозачаточные,
Phenobarbitonum, Primidonum, Ranitidinum*, Rifampicinum, Spironolactonum,
Vitaminum K, C.
4.6.2.3 Лабораторный контроль эффективных
доз АНД, внутри- и межлабораторный контроль качества анализов
Лабораторный контроль
При приеме АНД более четырех дней, а
особенно при продолжительном и интенсивном их применении, необходимы постоянное
установление и оценка эффективности действия и коррекция терапевтической дозы
лекарства. В настоящее время общепринятым в мире методом контроля АНД является
ТВ или ПВ (одностадийное), выражаемое в секундах, в процентах или в единицах
МНИ. В основе метода (более 60 лет назад предложенного А. Квиком и впоследствии
многократно модифицированного) положено определение скорости образования
сгустка фибрина в цитратной плазме крови больного при добавлении к ней смеси
кальция и тромбопластина. Тромбопластин является фосфолипидно-белковым
экстрактом из тканей животных и содержит тканевой фактор и фосфолипид,
необходимые для активации фактора X фактором VII.
ПВ чувствительно к изменениям активности
факторов II, VII, X, но плохо отражает изменения активности фактора IX. В
первые дни от начала приема АНД ПВ отражает динамику изменений фактора VII, так
как он первым подвергается влиянию АНД и только позже (обычно через 4-5 дней)
начинают снижаться концентрации и других зависимых от витамина К факторов
свертывания.
Проблема установления эффективной дозы АНД и
ее поддержание на терапевтическом уровне согласно клинической ситуации
осложняется тем, что разные лаборатории для определения ПВ используют различные
методы, инструменты и аппаратуру, а главное – реагент тромбопластина разной
активности и различного происхождения. Комплекс этих обстоятельств в
значительной степени затрудняет получение сравнимых с другими лабораториями
результатов, отвечающих современным требованиям контроля качества анализов и международным
правилам по стандартизации этих анализов.
До сих пор значительно варьирует источник
получения тромбопластина (мозг человека, мозг кролика, легкие, плацента
человека, но чаще рекомбинантный продукт) и вид животных (кролик, крупный
рогатый скот, обезьяны, человек). Различные тромбопластины неодинаково отражают
вызванные АНД изменения протромбинового комплекса, что, в свою очередь,
значительно снижает надежность подбора доз АНД и достижение оптимального
терапевтического эффекта. Поэтому в конце 70-х годов Всемирная организация
здравоохранения (ВОЗ) для стандартизации тромбопластиновых реагентов предложила
использовать Международный референтный препарат тромбопластина и новую
статистическую модель для калибрования тромбопластинов – международный индекс
чувствительности (МИЧ), который на упаковке реагента обязан проставить
изготовитель.
В зависимости от комплекса обстоятельств
(доступность качественных сертифицированных реагентов, финансы, технологическое
обеспечение лаборатории) возможны три уровня лабораторных анализов ПВ по
возрастающей надежности результатов:
1.
Определение ПВ
ручным способом или полуавтоматическим анализатором с использованием любого
тромбопластинового реагента. В таком случае для контроля качества анализов
используется пул цитратных плазм от здоровых людей, не принимающих лекарств,
влияющих на компоненты свертывания крови. Такой контрольный материал
используется не больше недели и заменяется другим пулом путем “накладки”
результатов определения ПВ обоих пулов в течение 1-2 дней. Результаты
выражаются в секундах с обязательным указанием нормальных значений или как
соотношение (индекс) ПВ больного к ПВ контрольной плазмы (пула). Надежность
анализов наименьшая и зависит от тщательности приготовления пулов контрольных
плазм и точности выполнения всех других технологических манипуляций. Каждая
лаборатория вырабатывает свои нормальные и терапевтические значения, поэтому
сравнение с другими лабораториями почти невозможно. Метод приемлем лишь в
исключительных случаях и не может быть рекомендован для широкого применения
(хотя раньше был единственным даже в больших лабораториях).
2.
Определение ПВ
ручным способом или полуавтоматическим анализатором с использованием
коммерческого реагента тромбопластина с известной активностью и контрольных
коммерческих плазм. Результаты выражаются как и в первом случае – в секундах, в
процентах или по соотношению (индекс). Надежность анализов выше. Даже в этом
случае каждая лаборатория самостоятельно устанавливает границы нормальных и
терапевтических значений, зависящих от метода измерения, типа оборудования и
реагентов. Метод может быть использован более широко, но не является абсолютно
надежным и сравнимым.
3.
Определение
активности протромбинового комплекса полуавтоматическим или автоматическим
анализатором с использованием коммерческого тромбопластина с обозначенным на
каждой изготовленной партии (лот) реагента МИЧ и нормальных и патологических
коммерческих контрольных плазм. Результаты анализов выражаются также в секундах
или в процентах, но чаще всего, как это рекомендует международная
стандартизация и ВОЗ, в единицах МНИ, который вручную или автоматически вычисляется
по следующей формуле:
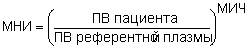
Международный комитет по изучению тромбозов
и гемостаза и Международный комитет по стандартизации в гематологии с 1983 г.
рекомендует выражать активность протромбинового комплекса больных в единицах МНИ,
производителям реагентов обозначать МИЧ на упаковках препаратов, редакциям
научных и профессиональных журналов, наряду с традиционным обозначением
результатов, указывать и МНИ.
МИЧ коммерческих препаратов или препаратов
тромбопластина собственного изготовления может быть установлен при сравнении их
активности с принятым ВОЗ международным стандартным тромбопластином из
человеческого мозга (тромбопластин сравнения Манчестера), имеющим МИЧ около
1,0.
Большинство коммерческих тромбопластинов
непригодны для исследования ПВ при уровне гепарина выше 0,6 МЕ/мл стандартного
гепарина или 0,6 анти-Xа МЕ/мл – низкомолекулярного, то есть при близких к
терапевтическим концентрациям гепаринов в крови. Невозможность установления
активности протромбинового комплекса в таких случаях не позволяет регулировать
дозы АНД и контролировать безопасный переход от одного антикоагулянта к
другому, особенно при развитии вызванной гепарином тромбоцитопении, или когда
может развиться кратковременная гиперкоагуляция при ускоренной замене,
недостаточной дозировке или преждевременной отмене АНД. Пренебрегая этим
правилом, невозможно выполнить и следующее:
Доза АНД индивидуальна и предписывается
только на основании данных стандартизированно установленного ПВ (ПИ) или МНИ, а
поддерживающая доза АНД должна точно соответствовать клинической ситуации.
Краткая характеристика варфарина. В клинике
применяется натриевая соль варфарина. Препарат представляет собой рацемическую
смесь R и S оптически активных изомеров, которые в печени метаболизируются с
различной скоростью. S-форма, как антагонист витамина К, примерно в 5 раз
активнее. Такие же различия наблюдаются и при их элиминации. Варфарин быстро
усваивается в пищеварительном тракте и соединяется с белками крови. Максимум
концентрации наблюдается в крови через 90 мин, полупериод циркуляции – 36-42 ч.
Снижают активность II, VII, IX, X факторов через их декарбоксилирование. Дозы
препарата подбираются по результатам определения ПВ, ТВ или МНИ
(терапевтическое окно 2-3 единицы МНИ). Врожденная толерантность требует приема
доз, в 20 раз превышающих обычные. При приеме АНД во время беременности
(разрешено с ограничениями только в первый и третий триместры) может влиять на
метаболизм костей плода, но существенно не меняет его у детей и взрослых. Целый
ряд лекарств изменяет метаболизм варфарина в печени, его усвоение и выделение.
Действие зависит от диеты больного, количества и качества употребляемых овощей
и содержания в них филлохинона. Период полураспада от 12 до 36 ч. Форма выпуска
– таблетки по 1, 2, 3, 4, 5, 6, 10 мг, а также по 2,5 и 7,5 мг. Для
парентерального (только внутривенно) введения выпускаются ампулы по 5 мг.
Период полураспада варфарина – 36-72 ч.
Максимальная концентрация в крови достигается через 2-8 ч.
Краткая характеристика аценокумарола
(синкумара). Элиминация
из плазмы R-формы происходит в 11 раз быстрее, чем S-формы. Максимум
концентрации в крови возникает через 24-48 ч. Период полураспада несколько
короче, чем варфарина, – 8,7 ч. Дозировка описана в разделе 4.1. Форма выпуска
– таблетки по 2 мг.
Краткая характеристика фенилина
(фениндиона).
Дозировка в первый день 120-180 мг, второй – 90-150 мг, последующие – 30-60 мг
под контролем ПВ или МНИ. Высшая доза для взрослых – 30 мг, суточная – 200 мг.
Форма выпуска – таблетки по 30 мг.
4.6.2.4 Режимы дозирования АНД
Дозирование АНД в условиях стационара
Варфарин
Начальная (насыщающая) доза.
В плановых (несрочных) случаях – 5 мг/сут. В
процессе подбора дозы ПВ или МНИ определяется ежедневно, пока не менее чем два
дня подряд будут получены стабильные результаты, соответствующие клинической
ситуации. Терапевтическая доза достигается за 5-6 дней. Первый месяц от начала
приема АНД проверяется ПВ или МНИ каждую неделю, позже – ежемесячно.
В срочных случаях – однократно 10 мг/сут. ПВ
или МНИ проверяется по такой же схеме, как при приеме дозы в 5 мг/сут до
достижения терапевтического уровня ПВ или МНИ.
Поддерживающая доза – 2-10 мг в зависимости
от чувствительности больного к АНД, других влияющих на лечение условий.
Контроль ПВ или МНИ – каждые 4-6 недель.
Аценокумарол
Начальная (насыщающая) доза – 4 мг/сут.
МНИ проверяется ежедневно в течение всего
процесса коррекции дозы препарата после достижения не менее чем в течение двух
дней стабильного результата соответственно клинической ситуации. Для подбора
терапевтической дозы аценокумарола необходимы 4-5 дней. Первый месяц от начала
приема препарата МНИ проверяется еженедельно, и при необходимости дозы
изменяются.
Поддерживающая доза – 2-6 мг/сут. МНИ
проверяется раз в месяц.
Правила отмены и замены АНД
1. Если возникает необходимость
прекратить лечение АНД, то доза препаратов в течение 3-4 дней постепенно
снижается и лишь после этого полностью отменяется.
2. При изменениях клинической ситуации и
с началом приема другого лекарства, взаимодействующего со свертывающей системой
крови, необходимо заново проверить эффективность поддерживающей дозы по МНИ.
3. Аценокумарол повышает проницаемость
кровеносных сосудов, поэтому больным с таким симптомом лучше назначить орфарин
или варфарин.
4. При замене одного АНД другим
дозирование нового препарата следует начать с начальной рекомендованной дозы и
только после определения ПВ или МНИ назначить поддерживающую дозу по
вышеописанным правилам.
5. При замене гепарина препаратами АНД
независимо от его сорта, оба лекарства (антикоагулянты прямого и непрямого
действия) необходимо принимать вместе 4-5 дней. В таких случаях контроль их
эффективности несколько усложняется, поскольку необходимо одновременно
определять АЧТВ и МНИ. АЧТВ должно быть удлинено 1,5–2,5 раза относительно
установленной лабораторией нормы, а АНД нужно дозировать так, чтобы в течение
этого времени МНИ достиг уровня, соответствующего клинической ситуации.
Установив начало эффекта АНД, доза гепаринов постепенно снижается и полностью
отменяется лишь после того, как МНИ установится на нужном терапевтическом
уровне.
Дозирование АНД в
амбулаторных условиях
Подбор дозы АНД в амбулаторных условиях
необходимо проводить с особенной тщательностью, учесть прерывистый контакт
больного с медицинским персоналом, клиническую ситуацию, противопоказания и
начать коррекцию дозы только после ознакомления больного с возможными ошибками
приема лекарства и возможными последствиями и осложнениями, а также внешними и
другими признаками этих состояний. Рекомендуется следовать следующим правилам:
·
Определить
исходные ПВ или МНИ и оценить общее состояние больного, особенно функцию печени
и почек (МНИ определяется не ранее 16 часов после приема очередной дозы АНД).
·
Выяснить, какие
лекарства, кроме намечаемых, больному предписаны.
·
Выбрать сорт АНД
и установить его начальную (насыщающую) дозу. Если это варфарин, то начальная
его доза – 5 мг/сут, если аценокумарол 4 мг/сут.
·
Первый контроль
ПВ или МНИ – на 4 сут; позднее дозы АНД коррегируются по показаниям ПВ или МНИ,
согласно инструкции АНД.
·
Повторный
контроль ПВ или МНИ – на 6-7-е сут, в течение первого месяца – еженедельно.
·
Поддерживающая
доза – согласно данным ПВ или МНИ. Если это варфарин – 2-10 мг/сут, если
аценокумарол – 2-6 мг/сут. Контроль ПВ или МНИ – ежемесячно.
·
Объяснить
больному признаки возможных осложнений при передозировке препарата, меры их
предупреждения и срочной помощи.
·
Начальная доза
снижается при удлиненном ПВ или увеличенном МНИ, нарушенном функционировании
почек и печени, сердечной недостаточности, парентеральном питании, значительно
пониженном индексе массы тела, возрасте старше 80 лет, при приеме конкурирующих
с АНД лекарств.
·
При необходимости
хирургического вмешательства доза АНД регулируется так: если планируется
незначительная операционная травма, то доза снижается до МНИ ниже 2,0, при
более травматизирующих операциях АНД отменяются на несколько дней, защищая
больного от возможных тромбоэмболий инъекциями гепарина (правила замены
антикоагулянтов и восстановления лечения АНД описаны выше). Необходимо всегда
помнить, что недостаточная доза расточительна, а передозировка – опасна для
жизни!!!
Дозирование АНД для
профилактики тромбоэмболии при различных клинических ситуациях
Приводимые рекомендации по дозированию
согласованы с изложенными в материалах 5-й Консенсус-конференции по
антитромботической терапии Американской коллегии грудных врачей (5th ACCP
Consensus Conference on Antithrombotic Therapy, 1988) и Методическими
рекомендациями 2001 г. той же коллегии (Guidlines for Antithrombotic Therapy. Fourth
Editiion. Summary of the American College of Chest Phisicians Recommendations,
2000. Jack
Hirsh, 2001).
Приведенные нами рекомендации не охватывают весь контингент больных,
нуждающихся в назначении АНД, и относятся только к некоторым группам, наиболее
часто посещающих врачей общей практики.
Для профилактики венозных тромбоэмболий АНД
назначают, придерживаясь рекомендаций, приведенных в табл. 3
Таблица 3. Профилактика и лечение тромбоза
глубоких вен конечностей и профилактика послетромбозного синдрома

Примечание. * – установлено первичное
гиперкоагуляционное состояние (дефицит протеина C, протеина S, антитромбина
III, плазминогена, повышенная концентрация фактора VIII) или найдены
антифосфолипидные антитела
При наличии противопоказаний для АНД или по
другим причинам не следует назначать АНД, возможно использование стандартного
или низкомолекулярных гепаринов (табл. 4).
Таблица 4. Назначение АНД при подозреии или
развитии ТЭЛА

Осложнения
Наиболее частые осложнения терапии АНД, их
локализация и последствия представлены в табл. 5.
Таблица 5. Осложнения АНД терапии

Кровотечение является наиболее частым
осложнением АНД терапии. По выраженности кровотечения это состояние
подразделяется на:
– большие геморрагии (внутричерепное,
ретроперитониальное), которые вызвали смертельный исход, требовалась
госпитализация или переливание крови;
– малые геморрагии, к которым причисляются
все остальные случаи кровотечений.
Факторы, увеличивающие риск кровотечения:
– первый месяц лечения (особенно первые 6-8
дней);
– интенсивное лечение АНД;
– клиническое состояние больного (возраст,
кровотечения в анамнезе);
– сопутствующие заболевания (болезни почек и
печени, врожденный и приобретенный дефицит факторов свертывания и др.);
– сочетанное лечение АНД с другими
лекарствами (особенно аспирином), влияющими на свертывающую систему крови,
большие дозы других антиагрегантов);
– продолжительность лечения;
– возраст старше 65 лет.
Частота кровотечений в зависимости от
интенсивности лечения АНД приведена в табл. 6.
Таблица 6. Частота кровотечений и интенсивность
лечения АНД 
Тактика врача при передозировке АНД
Передозировка АНД проявляется кровотечениями
из тканей и органов: десен, желудка, мочевыделительных путей, гениталий.
Особенно важно подчеркнуть, что кровотечение не всегда соответствует ПИ или
МНИ.
Основные причины передозировки:
1. Интенсивный курс лечения АНД.
2. Клиническое состояние больного.
3. Продолжительность лечения.
4. Характер заболевания и его
клиническое течение.
Ранние признаки передозировки
АНД: головная боль или
боли в области живота, потемнение мочи (если больной не питался продуктами,
окрашивающими мочу, например свекольный суп или др.).
При передозировке АНД и появлении признаков
кровотечения необходимо:
·
прекратить прием
АНД;
·
если этого
недостаточно, применить препараты витамина K. Каким образом их лучше применить
– решает врач на основании собственного опыта. Если принято решение вводить
витамин К в вену, препарат необходимо разбавить 0,9% раствором хлористого
натрия или 5% раствором глюкозы и вводить очень медленно (1 мг/мин) на
протяжении 10-20 мин. Таким способом можно избежать риска развития
анафилактической реакции на препарат. Подкожное введение значительно снижает
вероятность развития побочных реакций;
·
быстрый
гемостатический эффект достигается инфузией свежемороженой плазмы или
концентрата факторов II, IX и X.
Неудовлетворенность терапевтической
эффективностью АНД
Основные причины неудовлетворенности врачей,
назначающих АНД и контролирующих их эффективность, следующие:
– медленное начало действия (более 4 дней),
что ограничивает их применение в острых случаях;
– более низкий по сравнению с гепаринами
терапевтический результат;
– необходимость частого контроля
дозирования;
– взаимодействие со многими одновременно
применяемыми лекарствами;
– противопоказания при беременности;
– нередкая резистентность больных к АНД.
Эффективным препаратом,
обладающим антикоагуляционным, профибринолитическим, антиагрегатным и
ангиопротективным действиями, является препарат «Сулодексид». Его
назначают по 600 ЕД внутримышечно в сутки, в капсулах по 250 ЕД 2 раза в сутки
в течение 2–3 мес.
Через 5–7 сут после
начала приема гепарина переходят на оральные антикоагулянты или дезагреганты.
5. Антибактериальная
терапия
При выраженных местных и
общих проявлениях воспалительной реакции больным назначают пероральные
(ципрофлоксацин) или парентеральные эффективные антибиотики (цефазолин,
оксациллин, линкомицин, цефотаксим и др.) в течение 5–7 сут.
6. Хирургическое лечение
Если при динамическом
ультразвуковом исследовании или на илеокаваграфии имеются симптомы
прогрессирования тромба в проксимальном направлении или его флотации, показаны
хирургические методы лечения:
1. Тромбэктомия из подвздошных вен.
2. Пликация подвздошных вен и нижней
полой вены выше места тромба.
3. Установка съемного или постоянного
кава-фильтра.
Только эти методы могут
эффективно препятствовать тромбоэмболии легочной артерии.
После стихания активности
тромботического и воспалительного процессов больных выписывают на амбулаторное
лечение.
Заключение
Выводы
1. Тромбоз глубоких вен нижних
конечностей является распространенным и опасным по своим последствиям
заболеванием сосудов, что требует комплексной и интенсивной терапии в ранние
сроки возникновения заболевания.
2. Перечень препаратов необходимых для
консервативного лечения ТГВ:
·
Прямые
антикоагулянты (гепарин парентерально и местно в виде мазей, клексан,
фраксипарин);
·
Непрямые
антикоагулянты (варфарин и др.);
·
НПВП парентерально
и местно в виде мазей;
·
Показано
применение венотоников в остром периоде и в стадии реканализации.
3. При замене прямых
антикоагулянтов (независимо от его сорта) непрямыми антикоагулянтами, оба лекарства
необходимо принимать вместе 4-5 дней с постепенным снижением и затем полной
отменой гепаринов при поддержании ПТИ и МНО в терапевтических пределах.
4. Применение комплексной
терапии (антикоагулянтной и реологической) не имеет преимуществ перед
монотерапией антикоагулянтами.
5. Длительный прием прямых
антикоагулянтов более 5-7 дней увеличивает риск ретромбоза при неправильном
переходе на непрямые антикоагулянты, увеличивает продолжительность
стационарного лечения и стоимость лечения.
6. Экономически и
клинически более оправдано применение НМГ, чем НФГ.
Список литературы
1. Савельев В.С., « Флебология», М.:
Медицина. 2001 г.
2. Дибров М.Д., « Профилактика и
лечение тромбоза поверхностных и глубоких вен нижних конечностей»
3. Богачев В.Ю., « Лечение и
реабилитация больных тромбозом глубоких вен нижних конечностей», кафедра факультетской
хирургии РГМУ.
4. Ушкалова Е.А., «Рациональное
лекарственное лечение тромбоза глубоких вен конечностей», кафедра общей и
клинической фармакологии РУДН, серия «Медицина» 1999, №1, ст. 88-90.
5. Грибаускас П.С.,« Антикоагулянты
непрямого действия (применение, дозирование, показания и противопоказания,
лабораторный контороль, осложнения и первая помощь)», институт кардиологии
Каунасского медицинского университета.
6. Лазарев В.Н. « Опыт применения
детралекса в клинической практике при различных видах венозной патологии»,
флеболимфология 11/2000.ст.24-25.
7. Баешко А.А., «Сравнительная оценка
эффективности поли- и моновалентной антитромботической терапии тромбоза
глубоких вен нижней конечностей», журнал «Ангиология и сосудистая хирургия»,
№2, 2000 год
8. Панченко Е., «Профилактика и
лечение венозных тромбозов в клинике внутренней болезней», журнал «Врач», №2,
2000, ст. 6-9
9. В.С. Тарасенко, Н.А. Левашко, В.В.
Бобылев, В.В. Вдовенко, «Анализ профилактика и лечение тромбоэмболии легочной
артерии», Оренбургская Государственная Медицинская Академия Кафедра хирургии №
1
10. Рекомендации по диагностике и
лечению тромбоэмболии легочной артерии. (Отчет рабочей группы Европейского
общества кардиологов, 2000
11. Савельев
В.С., Думпе Э.П., Яблоков Е.Г. «Болезни магистральных вен». Москва,
1972 г.
