Введение
Пористые углеродные
материалы как сорбенты человечество использует на протяжении многих столетий.
Еще в XVІІI веке была открытая способность древесного угля очищать разные
жидкости и поглощать некоторые газы. К началу ХХ века углеродные сорбенты
(главным образом древесный и костный активный уголь) применяли преимущественно
в пищевой промышленности и виноделии для очистки жидкостей.
В настоящее время
основные направления использования углеродных сорбентов связаны с
технологическими процессами адсорбционного очищения. Пористые углеродные материалы сначала получали
преимущественно термической обработкой древесины, потом — каменного угля.
Сейчас их делают почти из всех видов углеродного сырья: древесины и целлюлозы,
каменного и бурого угля, торфа, нефтяного и каменноугольного пеков,
синтетических полимерных материалов, жидких и газообразных углеводородов,
разных органических отходов.
Глава 1. Общая
характеристика сорбционной очистки
сточных вод
Углеродные сорбенты
используют в разной форме: в виде порошка с размером частиц до 0,8 мм, гранул большего размера, блоков разной формы и величины, пленок, волокон тканей. Наиболее
распространенные порошковидные сорбенты, что достаточно просто получать зi
помельченного сырья.
Пористый углеродный материал
(ПВМ) являет собой конструкцию, построенную подобно структуре графита, однако в
ней чередуются упорядоченные и неупорядоченные области из углеродных колец — гексогенив
[1]. В отличие от графита ПВМ имеет свободное пористое пространство, что обычно
представлено трехмерным лабиринтом из взаимозависимых расширений и сужений
разного размера и формы. Различают микропоры (размер _ 2 нм), мезопоры (размер
в диапазоне от 2 до 50 нм) и макропоры с размером > 50 нм. Среди микропор
выделяют супермикропоры с размером в диапазоне 0,7-2 нм и ультрамикропоры с
размером < 0,6-0,7 нм. Благодаря наличию пор ПВМ имеют высокую удельную
поверхность и способные поглощать (адсорбировать) разные вещества из жидкостей
и газов. Понятие «адсорбция» трактуется как повышение концентраций
веществ вблизи деления фаз.
Способность ПВМ к
адсорбции разных молекул определяется зданием его поверхности, природой и
концентрацией поверхностных реакций групп. В качествах последних обычно
выступают функциональные группы, что образуются в результате окислительной
обработки поверхности углеродного материала: феноловые (гидроксильные),
карбонильные (хиноидни), карбоксильные, эфирные и другие [1] .
Все многообразие углеродных
сорбентов можно классифицировать за разными критериями: природы исходного сырья
(твердая, жидкая, газообразная), методам получения, структурными и текстурными
(пористость, поверхность, размеры и деление пор) характеристиками и областям
применения.
Пористые углеродные
материалы образуются в результате протекания топонимических реакций при
пиролизе (нагревании при отсутствии кислорода воздуха) ископаемого угля, торфа,
древесины, целлюлозы, карбидов. В настоящее время из древесины делают около 36
% углеродных сорбентов, из каменных углей — 28, из бурых углей — 14, из торфа —
10.
Глава 2. Неуглеродные сорбенты в процессах
водоочистки
сорбционный
сточный ион металл
Для очистки
воды все большее применение находят неуглеродные сорбенты естественного и искусственного
происхождения (глинистые породы, цеолиты и некоторые другие материалы).
Использование
таких сорбентов обусловлено достаточно высокой емкостью их, избирательностью,
катионообменными свойствами некоторых из них, сравнительно низкой стоимостью и
доступностью (иногда как местного материала).
Глинистые
породы — наиболее распространенные неорганические сорбенты для очистки воды.
Они обладают развитой структурой с микропорами, имеющими различные размеры в
зависимости от вида минерала. Большая часть из них обладает слоистой жесткой
или расширяющейся структурой.
Механизм
сорбции загрязнений на глинистых материалах достаточно сложен и включает
Ван-дер-ваальсовые взаимодействия углеводородных цепочек с развитой
поверхностью микрокристаллов силикатов и кулоновское взаимодействие заряженных
и поляризованных молекул сорбата с положительно заряженными участками
поверхности сорбента, содержащими ионы Н+ и Al3+.
Наибольшее
распространение глинистые материалы получили для обесцвечивания воды, удаления
неорганических примесей и особо токсичных хлорорганических соединений и
гербицидов, различных ПАВ.
Природные
сорбенты добывают в непосредственной близости от места потребления, что
постоянно расширяет масштаб их применения для очистки воды.
Цеолиты —
разновидности алюмосиликатных каркасных материалов. Эти материалы имеют
отрицательный трехмерный алюмосиликатный каркас со строго регулярной
тетраэдрической структурой. В промежутках каркаса находятся гидратированные
положительные ионы щелочных и щелочно-земельных металлов, компенсирующих заряд
каркаса, и молекулы воды. В адсорбционные полости цеолитов сорбируется лишь
молекулы веществ, критический размер которых меньше эффективного размера
входного окна, от этого и их второе название — молекулярные сита.
Известно
более 30 видов природных цеолитов, но лишь часть из них образует крупные
месторождения (80% концентратов) удобные для промышленной переработки. Наиболее
распространенные природные цеолиты:
·
шабазит (Na2Ca)O
•Al2O3 •4SiO2 •6H2O с размером окон
0.37-0.50 нм;
·
морденит (Na2K2Ca)O
•Al2O3 •10SiO2 •6.7H2O с размером
окон 0.67-0.70 нм;
·
клинопптиломит
(Na2K2Ca)O •Al2O3 •10SiO2 •8H2O
Для получения
прочных и водостойких фильтрующих материалов из природных цеолитов их, так же,
как и глины, нагревают в печах с хлоридом карбонатом натрия при 10000С.
Обработка
поверхности цеолитов кремнийорганическими соединениями делает ее гидрофобной,
что улучшает сорбцию нефти из воды.
Природные
цеолиты используются в виде порошков и фильтрующих материалов для очистки воды
от ПАВ, ароматических и канцерогенных органических соединений, красителей,
пестицидов, коллоидных и бактериальных загрязнений.
Кроме
цеолитов и природных глин перспективными являются неорганические иониты.
Среди них
можно выделить следующие:
1.
Гранулированные
методом замораживания труднорастворимые фосфаты металлов (циркония, титана,
хрома, железа, тория, сурьмы и др.), прежде всего, цирконилфосфат (ZrO)m(H2PO4)n
с различным отношением m:n, отличающийся высокой емкостью обмена, термической и
радиационной устойчивостью и высокой селективностью к ионам цезия, рубидия,
калия и аммония, а также таллия. Цирконилфосфат устойчив в концентрированных
кислотных и солевых растворах, сохраняя в них высокую ионообменную емкость и
избирательность к вышеуказанным катионам. Цирконилфосфат может быть использован
для извлечения из сильнокислых и сильноминерализованных радиоактивных растворов
долгоживущего изотопа 137Cs; для разделения продуктов радиоактивного
распада урана в атомных реакторах: 89Sr-137Cs, 89Sr-144Cs,
90Sr-90U; для отделения 95Nb и 95Zr
от 106Ru; для извлечения ионов таллия из растворов в производстве и
при использовании солей таллия.
2.
Синтетические
титано- и цирканосиликаты, обладающие молекулярноситовыми свойствами
цеолитового уровня, высокой обменной емкостью и селективностью к ряду катионов.
3.
Труднорастворимый
кристаллический оксалат циркония, селективный по отношению к катионам свинца и
калия.
4.
Труднорастворимые
соли поли- и гетерополикислот: фосфомолибдаты, фосфорвольфраматы, вольфраматы,
фосфорарсенаты, производные фосфорносурьмяной кислоты, кремнесурьмяной кислот и
другие обладающие селективностью к редким щелочным, щелочноземельным и тяжелым
металлам.
5.
Ферроцианиды
щелочных и тяжелых металлов (железа, меди, цинка, молибдена, никеля, титана,
олова, ванадия, урана, вольфрама и т.п.), способные к избирательной сорбции
ионов Pb+, используются для поглощения Rb, Cs из растворов и Tl+
из водных растворов. Например, с помощью ферроцианида щелочного металла и
никеля эффективно извлекается рубидий из отработанного раствора при переработке
карналлитовых руд.
6.
Нерастворимые
сульфиды и гидроксиды металлов. Например, известно о возможности успешной
очистки никелевых электролитов от примесей ионов меди, свинца, кадмия, мышьяка,
сурьмы, олова, висмута с помощью нерастворимого сульфида никеля, от примесей
железа (II) и кобальта (II) с помощью гидроксидов никеля в сочетании с
органическим сильноосновным анионитом АВ — 17 на конечной стадии очистки.
Многие катиониты в том
числе цеолиты (за исключением клиноптилолита, эрионита и морденита) и глинистые
минералы, могут работать только в солевых формах (натриевой, кальциевой и т. д.).
Они не могут быть переведены в водородную форму, так как при этом разрушается
их структура, и, следовательно, не могут применяться в технологии обессоливания
и опреснения сточных и природных вод. Кроме того, обессоливание воды невозможно
без одновременного использования анионитов, которые среди неорганических
минералов и соединений встречаются весьма редко.
Эти
обстоятельства в немалой степени способствовали бурному развитию синтеза
органических катионитов и анионитов на основе синтетических органических
соединений, получивших широкое применение в технологии обессоливания воды, в
гидрометаллургии драгоценных и цветных металлов, в технологии очистки сточных
вод и в других отраслях.
Органические иониды
Методы регенерации сорбентов
Методы
регенерации условно можно разделить на три вида:
1.
Химический
2.
Низкотемпературный
термический
3.
Термический
Химическая
регенерация
Под
химической регенерацией понимают обработку сорбента жидким или газообразным
органическими или неорганическими реагентами при температуре, как правило не
выше 1000С. Химически регенирируют как углеродные, так и
неуглеродные сорбенты. В результате этой обработки сорбат либо десорбируется
без изменений, либо десорбируются продукты его взаимодействия с регенерирующим
агентом. Химическая регенерация часто протекает непосредственно в адсорбционном
аппарате. Большинство методов химической регенерации узкоспециальны для
сорбатов определенного типа. Рассмотрим некоторые примеры химической
регенерации активных углей.
Самый простой
метод регенерации сорбента — нагревание его в некотором объеме воды. Это
приводит к росту степени диссоциации и растворимости сорбата и, в итоге, к
десорбции части сорбата. Так при регенерации активного угля нагревают воду и
фильтруют ее через активный уголь. Эффект такой регенерации не выше — 20-40 %.
Из всех
методов химической регенерации угля наибольшее распространение, особенно в
водоподготовке, получила обработка активных углей растворами гидроокиси и
карбоната натрия.
Регенерация
2.5% NaOH позволяет в 8 раз использовать уголь КАД-иодный для дезодорации воды
(после 4-кратной регенерации) снижение сорбционной емкости составляет 40-50%.
Наличие плохоомыляемых примесей снижает со временем емкость угля.
Десорбция
органического сорбата с активного угля растворами кислот используется
сравнительно редко. (2.5 % раствор Н2SO4 десорбирует
некоторые пестициды). Чаще кислоты служат окислителем сорбата на угле.
Окислителем органического сорбата может быть и H2O2.
В последнее
время изучаются методы регенерации с использованием гамма-излучения, под
воздействием которого происходит деструкция сорбата. В малых дозах это
излучение инициирует окисление кислородом на активном угле органических соединений,
присутствующих в воде CO2 и H2O. Доза облучения 3•104
рад/ч обеспечивает окисление аэрацией кислородом в воде таких соединений как
лигнин, лигнинсульфат, бескислородная деструкция их требует дозы 1.1•106
рад/час.
Низкотемпературная
термическая регенерация
Низкотемпературная
термическая регенерация — это обработка сорбента паром или газом при 100-4000С.
Процедура эта достаточно проста и во многих случаях ее ведут непосредственно в
адсорберах.
Водяной пар
вследствие высокой высокой энтальпии чаще других используют для
низкотемпературной термической регенерации. Он безопасен и доступен в
производстве.
Для пропарки
адсорбера необходимы лишь парогенератор и холодильник-конденсатор. Отработанный
конденсат направляется либо на сжигание, либо на выделение ценного сорбата.
Термическая
регенерация
Химическая
регенерация и низкотемпературная термическая регенерация не обеспечивает
полного восстановления адсорбционных углей.
Термическая
регенерация процесс весьма сложный, многостадийный, затрагивающий не только сорбат,
но и сам сорбент. Термическая регенерация приближена к технологии получения
активных углей.
При
карбонизации сорбатов различного типа на угле большая часть примесей
разлагается при 200-3500С, а при 4000С обычно разрушается
около половины всего адсорбата. CO, CO2, CH4 — основные
продукты разложения органического сорбата выделяются при нагревании до 350-6000С.
В теории
стоимость такой регенерации составляет 50 % стоимости нового активного угля.
Это говорит о
необходимости продолжения поиска и разработки новых высокоэффективных методов
регенерации сорбентов.
Сорбенты для очистки воды
и их короткая характеристика
Для очистки стоковых вод
используют много материалов естественного и искусственного происхождения, но чаще
используют естественный уголь. Пока не удалось найти другого материала, который
был бы таким эффективным как активный уголь (АВ). В настоящее время для сорбции
из водных растворов используют гранулированный и порошковидный уголь, а также
углеродные волокна.
Активный уголь — это
пористые тверди тела, пустоты которых связаны между собой так, что структура их
напоминает древесину. В зависимости от условий формирования весь активный уголь
имеет моно- или полидисперсную структуру. Они состоят из многих беспорядочно
расположенных микрокристаллов графита, которые образовались в результате
соединения углеводных атомов при нагревании углеродного сырья. Для изготовления
активного угля может служить: уголь, древесина, полимеры, отходы пищевой,
целлюлозной и других отраслей производства. Изготовление активного угля состоит
из двух этапов: карбонизация сырья и активация полупродукта [1]. По способу
производства АВ делится на дробимое — БАУ, ДАК, КАД — да и собственно
гранулировано — АГ — 3, АГ — 5, скг.
Предварительно размолотую
и отсортированную сырье карбонизируют в барабанных печах (700 – 800 0С)
без доступа воздуха.
Активация — наиболее
сложная и ответственная стадия получения АВ.
Активирующими агентами
могут быть кислород, водяная пара, углекислый и серный газы, а также
неорганические соединения: хлориды цинка и кальция, сульфат, сульфид или
карбонат калию, многообразные фосфаты. По окончанию активации неорганические
активируя добавки вымывают из продукта.
Kроме активного угля
широкое применение как сорбенты в процессах адсорбции находит активный окисел
алюминия. В промышленных масштабах его получают переосаждением гидрату
глинозема путем его растворения в кислотах (серной, азотной) или в лузе (едкому
нaтpию) со следующим гидролизом, формированием, сушкой и прожариванием.
Свойства синтезированного окисла зависят от структуры и морфологии выходного
гидроксиду, а также от условий термообработки. Существует большое число
модификаций окисла алюминия. В промышленности активный окисел алюминия в
зависимости от назначения, выпускается в основном трех сортов, каждый Из
которых содержит в себе ряд марок [2].
Личные сорбционные свойства
имеют цеолит, который являет собой пористые кристаллические алюмосиликаты со
строго регулярной кристаллической структурой.
Они используются в
промышленности для глубокой осуши та очистка газов и жидкостей. Общая формула
цеолита: М2мО« А12Оз» nSiO2″ Н2О. Здесь М — катион, что имеет
валентность м; n — коеффициент, что характеризует тип цеолита, иногда
называется силикатным модулем; к — количество молекул воды.
Цеолит достаточно
распространен в природе: встречаются в вулканическом туфе, базальте,
пегматитових жилах и т.д. В промышленности, как правило. использует цеолит,
полученный синтетическим путем – Гидротермальной кристализацией щелочных
алюмосиликагелей. В процессе кристаллизации гидрогель превращается в
мелкодисперсный порошок цеолита, что после промывания гранулируется с
добавлением сопроводительного — глины. Введение соединений приводит к изменению
ряда физико-химических свойств цеолита: каталитической активности,
адсорбционной емкости, механической прочности и др. Потому промышленностью
освоенный выпуск гранулированного цеолита, который не содержит веществ,
кристаллизацией предварительно сформированного алюмосиликата. Естественный
цеолит использует в виде порошков и фильтрующих материалов для очистки воды от
синтетических поверхностно активных веществ (СПАРЬ), ароматических и
канцерогенных органических соединений, красителей, пестицидов, коллоидных и
бактериальных загрязнителей . [3]. Диатомиты, трепелы и опоки присутствуют в
промышленности как адсорбенты разных жидкостей. По природе они являются
осадочными горными породами.
Глава 3. Новый сорбент на
основе природных материалов для очистки гальванических стоков
Загрязненные
производственные стоки представляют угрозу для водных объектов, так как
содержат высокотоксичные вещества, среди которых наиболее опасны соединения
тяжелых металлов. Последние, попадая в окружающую среду и взаимодействуя с
другими элементами, образуют токсиканты, даже незначительные количества которых
могут нанести вред здоровью человека и состоянию окружающей среды. Тяжелые
металлы, включаясь в пищевую цепь, способны концентрироваться в организме до
количеств, в сотни и тысячи раз превосходящие их содержание в водной среде.
Следует отметить, что металлы обладают ярко выраженным эффектом суммации, из-за
чего совместное присутствие нескольких элементов усиливает их токсическое
действие. Поэтому следует создавать водооборотные
циклы на предприятиях с учетом регенерации отработанных технологических
растворов, сточных вод и локальные замкнутые системы водопользования, которые
являются основным звеном замкнутых систем водного хозяйства промышленных
предприятий в целом. На машиностроительных предприятиях
Алтайского края при нанесении гальванических покрытий образуются сточные воды,
содержащие ионы меди и цинка. Поскольку данные стоки разнообразны по составу и
свойствам, объединение их для последующей очистки нерационально. Выделение ионов тяжелых металлов из воды возможно различными
способами: реагентными, адсорбционными, ионообменными, электрохимическими, а
также выпариванием. Выбор способа зависит от масштабов производства,
концентрации металлов в сточных водах, их стоимости. Наиболее часто применяют
реагентное осаждение. Однако этот способ вызывает вторичное загрязнение воды и
потерю ценных компонентов с осадками. Кроме того, осаждение, как правило,
осуществляется известью, из-за чего в очищенной воде увеличивается содержание
солей кальция, что затрудняет ее использование в оборотном водоснабжении. Так же интенсивно используют ионный обмен, что позволяет
применять широкий спектр ионообменных материалов, например природные
бентонитовые глины. Как правило, глубина залегания бентонитовых глин достаточно
небольшая, что делает возможным их добычу открытым способом, благодаря чему они
имеют невысокую стоимость. В составе
бентонита преобладающим минералом является монтмориллонит с ярко выраженными
ионообменными свойствами. Монтмориллонит содержит катионы металлов, которые
выступают в качестве обменных катионов. Наиболее распространенным обменным
катионом в бентонитах является Са2+, но значительно большей
активностью обладают катионы Na+, К+ и Н+. Известны сорбционно-ионообменные материалы, созданные на
основе бентонитовых глин путем их нанесения на поверхность базальтовых волокон
[1]. Такие комплексы могут быть использованы для очистки стоков, содержащих
тяжелые металлы. Однако определенные трудности связаны как с самим процессом
нанесения бентонитовых глин на базальтовые волокна, так и с невысокой
механической прочностью полученного сорбента. Поэтому интересен поиск других материалов, которые могут служить каркасом при нанесении
бентонитовых глин.
На
многих предприятиях в качестве отходов вспомогательного производства образуются
древесные опилки, которые можно использовать в качестве фильтровальных
загрузок, но чаще всего их сжигают в котельных. В связи с этим экономически
целесообразно использовать древесные опилки в качестве материала для очистки
сточных вод и получения новых сорбционных материалов путем нанесения на них
активного комплекса, например бентонитов.
Использование
подобных недорогих сорбентов делает привлекательным создание водооборотных
систем на гальванических производствах. Так как основное количество воды (95 —
98 %) при нанесении гальванических покрытий приходится на промывные операции,
возврат в технологический процесс воды от ванн промывки создает основу для
организации замкнутого водного хозяйства [2].
Известно,
что сорбционная способность отходов деревообрабатывающего производства, в том
числе древесных опилок, по отношению к ионам металлов невысока. Для ее
увеличения опилки необходимо подвергнуть модификации, например бентонитами.
Опилки при этом являются основой, на которую наносится бентонитовая глина в
соотношении бентонит: опилки от 1:1 до 1:3.
Компоненты
смешивают, высушивают для удаления излишков воды, полученную массу измельчают
до фракции размером 3 — 15 мм, затем для придания необходимых механических
свойств спекают при определенной температуре.
При
проведении исследований использовались бентонитовые глины Таганского
месторождения с преобладанием катионов натрия (натриевая) и кальция
(кальциевая). Для увеличения ионообменной емкости кальциевого бентонита путем освобождения
активных центров проводилась его содовая активация 5 %-ным раствором соды.
Избыток соды из бентонита удалялся при промывке водой. Затем активированный
бентонит отделялся от воды и высушивался. Поскольку натриевый бентонит содержит
катионы натрия, которые обладают большей активностью, он не подвергался
активации [3].

Были
получены три вида нового сорбционно-ионообменного материала, названного
«Беном» (рис. 1), с соотношением бентонитюпилки 1:1, 1:2 и 1:3.
Исследовали
способность сорбента извлекать катионы меди и цинка из водных растворов. Для
этого были приготовлены модельные растворы сульфатов меди и цинка с
концентрацией ионов металла от 10 до 1000 мг/л. В емкости с 100 мл раствора
добавляли по 1 г глины, перемешивали и отстаивали суспензию. Затем проводили
фотометрический анализ осветленного раствора.
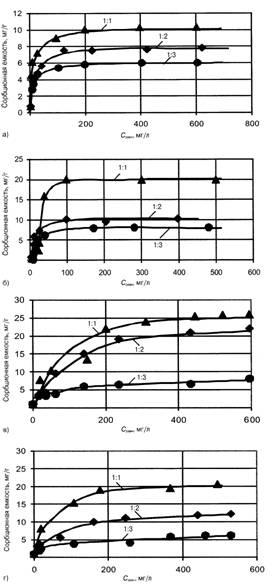
Лучшие
результаты по очистке воды от ионов меди и цинка показал материал,
приготовленный из кальциевого бентонита с содовой активацией (рис. 2).
Пропорционально количеству вводимого бентонита изменялась сорбционная емкость
«Бенома».
Сорбционная
емкость по ионам меди при соотношении бентонита и опилок 1:1 в 2 раза больше
при использовании кальциевого бентонита. С увеличением количества опилок эта
разница снижается и при соотношении бентонит:опилки 1:3 оба вида материала
имеют одинаковую емкость по отношению к ионам меди (6 — 7 мг/г).
Сорбционная
емкость по ионам цинка «Бенома» из натриевого бентонита (см. рис. 2, в) при соотношении бентонитюпилки 1:1 и 1:2 больше, чем
по ионам меди. Максимальная емкость при соотношении бентонита и опилок 1:1
составляет 25 мг/г, уменьшение доли бентонита снижает сорбци-онную емкость до
22 мг/г.
В
отличие от ионов меди извлечение ионов цинка «Беномом» с кальциевым
бентонитом происходит менее эффективно (см. рис. 2, г): максимальная сорбционная емкость при соотношении бентонит:опилки 1:1 и 1:2 составляет 20 и 12
мг/г.
Для
сорбента с соотношением бентонита и опилок 1:3 выявлено незначительное
изменение сорбционной емкости как по ионам меди, так и по ионам цинка. Вид
бентонитовой глины практически не влияет на характер сорбции.
С
целью выявления основных параметров работы сорбционно-ионообменного модуля с
предлагаемой загрузкой были проведены эксперименты по очистке воды в
динамических условиях на фильтровально-ионообменной установке.
«Беном» с соотношением бентонит:опилки 1:2 (поочередно натриевый и
кальциевый) помещали в модуль диаметром 35 и высотой 300 мм. Высота слоя сорбента — 100 мм, масса — 100 г. Для измерения расхода жидкости установка была
оснащена поплавковым ротаметром, для измерения перепада давления на фильтре —
ртутным дифманометром.
Исследовали
водные растворы сульфатов меди и цинка с концентрацией 50 мг/л, что
соответствует средней концентрации промывных вод процессов меднения и
цинкования. Скорость фильтрования раствора поддерживалась постоянной (3 — 5
м/ч).
На
рис. 3 видно, эффективность очистки практически не зависит от удельного объема
профильтрованного раствора и вида используемого бентонита.
Степень
очистки от ионов меди при пропускании первых порций раствора достаточно велика
(90 %) (см. рис. 3, а), затем она уменьшается, что можно
объяснить быстрым заполнением активных центров бентонита. При удельном объеме
пропущенного раствора более 2,5 л/г степень очистки снижается до 20 %.
Данные,
полученные при очистке растворов от ионов цинка, свидетельствуют о том, что
степень очистки также достаточно велика при пропускании первых порций раствора
(см. рис. 3, б). Однако более резкое снижение
эффективности (до 20 %) наблюдается при пропускании удельного объема 1,5 л/г
для сорбента с кальциевым бентонитом и 0,8 — для сорбента с натриевым
бентонитом.
Важным
условием для промышленного использования предлагаемой загрузки является
возможность ее регенерации. Изучение влияния числа регенераций на величину
фильтроцикла после каждой серии опытов проводилось путем регенерации загрузки
раствором соды (рис. 4). Видно, что в целом фильтроцикл уменьшается с ростом
числа регенераций. Однако фильтроцикл сорбента с натриевым бентонитом
значительно меньше, чем сорбента с кальциевым бентонитом. После четырех
регенераций время защитного действия цикла не превышало 2,6 ч, что позволяет
говорить о нецелесообразности дальнейшей регенерации. Отработанный сорбент
можно утилизировать сжиганием. Несгоревшую минеральную фракцию можно опять
использовать при получении «Бенома».
По
результатам проведенных исследований можно сделать следующие выводы:
•
полученный фильтровально-сорбционный материал можно использовать для извлечения
ионов меди и цинка из водных растворов, лучший результат показал материал с
соотношением бентонит:опилки 1:1;
• вид
применяемого бентонита не оказывает существенного влияния на сорбционные
свойства материала;
•
сорбент можно регенерировать 3 раза, затем его следует утилизировать.
Результаты
исследований были положены в основу разработки принципиальной технологической
схемы очистки промывных вод гальванических производств (рис. 5).
Воды
из ванн промывки гальванических покрытий поступают в усреднитель /, откуда
центробежным насосом 2 последовательно подаются на первую и
вторую ступени ионного обмена. Промывные воды после ионообменной обработки
поступают в сборник 11, пройдя предварительную очистку в
механосорбционном фильтре 10. Этот фильтр
служит для удаления из фильтрата вымывающихся частиц загрузки. Очищенная вода
возвращается в производство и периодически подается на промывку фильтра 10, загрязненная вода возвращается в усреднитель.
Приготовление
сорбента осуществляется следующим образом. В емкость 4 подаются увлажненные водой опилки, которые с помощью
ковшового дозатора 5 загружаются в емкость для приготовления сорбента 8, куда также подается бентонитовая глина из емкости 9. В емкости 8 материалы
перемешиваются, направляются на спекание в печь 6, затем в фильтр 3 на поддерживающую сетку. Удаление
использованной загрузки осуществляется гидротранспортом из верхней части
фильтра. Отработанный сорбент собирается в отстойнике 7, где обезвоживается.
Вода возвращается в усреднитель, а опилки утилизируются после трехкратной
регенерации сжиганием.
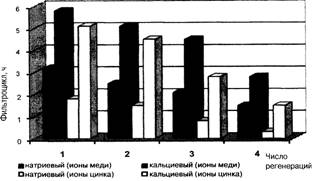

Рис.
5. Схема очистки промывных вод гальванических производств с применением
«Бенома»: I — усреднитель; 2 —
насос; 3 — сорбционно-ионообменные фильтры; 4 — емкость для опилок; 5 —
ковшовый дозатор; 6 — печь обжига; 7 —
емкость для отработанного сорбента; 8 — емкость для приготовления сорбента; 9 —
емкость для бентонита; 10
— механосорбционный
фильтр; II — емкость для очищенных стоков
Внедрение
описанной схемы позволит создать замкнутый во-дооборотный цикл на предприятии и
снизить нагрузку на окружающую среду.
Литература
1.
Кондратюк Е.В.,
Лебедев И.А., Комарова Л.Ф. Очистка сточных вод от ионов свинца на
модифицированных базальтовых сорбентах // Ползу-новский вестник. 2006. № 2-1.
2.
Сомин В.А.,
Полетаева М.А., Комарова Л.Ф. Создание водообо-ротных систем с очисткой сточных
вод от ионов тяжелых металлов // Ползуновский вестник. 2008. № 3.
3.
Кондратюк Е.В.,
Комарова Л.Ф. Перспективы создания волокнистых ионообменных материалов на
основе природного минерального сырья // Изв. вузов. 2009. Т. 52. Вып. 2.
4.
Когановский А.М. Адсорбция и ионный обмен в процессах
водоподготовки и очистки сточных вод. Киев: Наук. думка. 1983. 240 с.
5.
Смирнов А.Д.
Сорбционная очистка воды. Л.: Химия. 1982. 168 с.
6.
Клячков В.А.,
Апельцин И.Э. Очистка природных вод. М.: Стройиздат. 1971. 579 с.
7.
Смирнов Д.Н.,
Генкин В.Е. Очистка сточных вод в процессах обработки металлов. М.:
Металлургия.1980. 195 с.
8.
Аширов А.
Ионообменная очистка сточных вод, растворов и газов. Л.: Химия. 1983. 295 с.
